
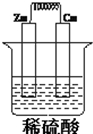
 如图所示,将锌,铜通过导线相连,置于稀硫酸中构成原电池,完成下空
如图所示,将锌,铜通过导线相连,置于稀硫酸中构成原电池,完成下空分析 该原电池中,Zn易失电子作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+,正极上电极反应式为2H++2e-=H2↑,导致负极上金属逐渐减少,正极上有气泡产生,电流从正极流向负极,据此分析解答.
解答 解:(1)该原电池中,Zn易失电子作负极、Cu作正极,负极上铁失电子发生氧化反应生成锌离子进入溶液,电极反应式为Zn-2e-=Zn2+,故答案为:负极;Zn-2e-=Zn2+;
(2)Zn易失电子作负极、Cu作正极,反应过程中电流的方向为从正极流向负极,故答案为:A;
(3)正极反应为:2H++2e-=H2↑,当锌片溶解0.65g时,即消耗Zn为0.01mol,转移电子为0.02mol,则铜上生成的氢气为0.01mol,在标准状况下体积为0.224L,故答案为:0.02;0.224.
点评 本题主要考查了原电池及计算,明确正负极的判断方法及电极上发生的反应是解本题关键,根据电极反应确定发生的现象,题目难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:推断题
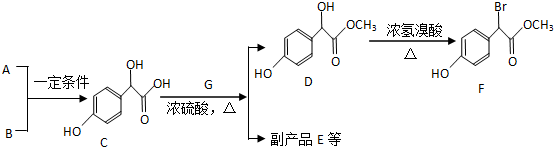
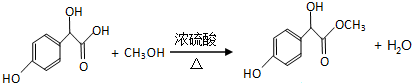
 .
.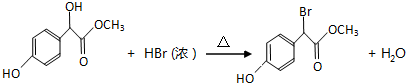
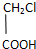
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把绿豆大的钾投入水中 | |
| B. | 把除去氧化膜的镁带放入少量冷水中 | |
| C. | 把溴水滴加到KI溶液中,并加入少量四氯化碳溶液 | |
| D. | 把铜片和铁片紧靠在一起浸入稀硫酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①②④⑤ | C. | ②⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2为0.2mol/L | B. | Y2为0.35mol/L | ||
| C. | XY为0.25mol/L | D. | X2,Y2,XY总浓度为0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
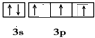 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com