
| A. | 原子核外每一个能层最多可容纳的电子数为n2 | |
| B. | 任一能层的能级总是从s能级开始,而且能级数等于该能层数 | |
| C. | 不同能层中s电子的原子轨道半径相同 | |
| D. | 不同能层中p电子的原子轨道能量相同 |
分析 A.根据核外电子排布规律:各电子层最多容纳电子数2n2(n为电子层数);
B.能层为原子核外电子层,能级为每一能层的电子亚层,根据能层与能级的关系;
C.能层序数越大,s原子轨道的能量越高,轨道的半径越大;
D.离原子核越远的电子,其能量越大.
解答 解:A.各电子层最多容纳电子数2n2(n为电子层数),故A错误;
B.任一能层的能级总是从s能级开始,而且能级数等于该能层序数,即原子轨道类型数目等于该电子层序数,如第一层(K层)上只有1S亚层,第二电子层(L层)只有2s和2p亚层,第三电子层(M层)只有3s、3p和3d亚层,第四电子层(N层)只有4s、4p、4d和4f亚层,故B正确;
C.能层序数越大,s原子轨道的能量越高,轨道的半径越大,故C错误;
D.离原子核越远的电子,其能量越大,所以p原子轨道电子的平均能量随能层的增大而增加,故D错误;
故选B.
点评 本题考查原子核外电子排布,题目难度不大,注意能层与能级间的关系,掌握原子核外电子排布规律是解答关键.


科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | T、Q的氢化物常温常压下均为无色气体 | |
| B. | L、M的氢氧化物碱性:L>M | |
| C. | L与Q形成的化合物属于离子化合物 | |
| D. | M与T形成的化合物具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔沸点:X2Y>X2R | |
| B. | WY2能与碱反应,但不能与任何酸反应 | |
| C. | Z与Y形成的化合物不能作为耐高温材料 | |
| D. | 原子半径按X、Y、Z、R、W的顺序依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Po的晶体堆积模型是简单立方堆积,其配位数是8 | |
| B. | 原子晶体中原子以共价键结合,具有键能大,熔点高,硬度大的特点 | |
| C. | 氯化钠晶体中,每个晶胞中平均含有4个钠离子和4个氯离子 | |
| D. | 在冰晶体中,每一个水分子周围有4个水分子紧密相邻 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
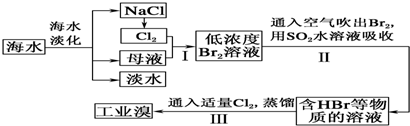
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是研究部分元素氢化物的沸点变化规律的图象,折线c可以表达出第ⅣA族元素氢化物的沸点变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是b(填“a”或“b”),理由是A点所示的氢化物是水,其沸点高是由于水分子间存在氢键,所以氧族元素中其他氢化物的沸点不会高于水.
如图是研究部分元素氢化物的沸点变化规律的图象,折线c可以表达出第ⅣA族元素氢化物的沸点变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是b(填“a”或“b”),理由是A点所示的氢化物是水,其沸点高是由于水分子间存在氢键,所以氧族元素中其他氢化物的沸点不会高于水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmol NH2-中含有9 NA个电子 | |
| B. | 等质量的甲烷、乙烯、1,3-丁二烯分别在空气中充分燃烧,所耗用氧气的量依次减小 | |
| C. | 46g C2H5OH燃烧放出的热量为乙醇的燃烧热 | |
| D. | 常温下,56g铁粉与足量浓硝酸反应,电子转移数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
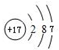
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
 ;
; ;④电子式表示A和B元素组成的化合物的形成过程:
;④电子式表示A和B元素组成的化合物的形成过程: .
.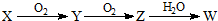
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com