
| 1 |
| 2 |
| 1g |
| 32g/mol |
| 1 |
| 32 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
| A、用石墨电极电解氯化铜溶液时,若阴极增重64 g,则阳极能产生NA个氯气分子 |
| B、25℃,pH=1的稀硫酸中含有的H+数为0.1 NA |
| C、用石墨电极电解饱和食盐水,当阴极产生2.24 L H2时,转移的电子数一定为0.2 NA |
| D、100 mL 1 mol?L-1的NH4Cl溶液中,NH4+的数目等于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
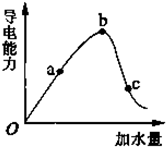 一定温度下,冰醋酸和水稀释过程中溶液的导电能力曲线如图所示,请回答:
一定温度下,冰醋酸和水稀释过程中溶液的导电能力曲线如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
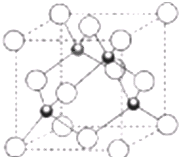 原子序数小于36的X、Y、Z、W四种元素,其中X是周期表中半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是周期表中半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com