


科目:高中化学 来源: 题型:
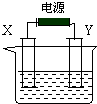 氯碱工业中电解饱和食盐水的原理示意图如图所示,X和Y均为电极石墨,电解液为滴有酚酞的饱和食盐水.
氯碱工业中电解饱和食盐水的原理示意图如图所示,X和Y均为电极石墨,电解液为滴有酚酞的饱和食盐水.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△G>0,△S<0 |
| B、△G<0,△S>0 |
| C、△G>0,△S>0 |
| D、△G<0,△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.32 mol?L-1?s-1 |
| B、0.16 mol?L-1?s-1 |
| C、1.6 mol?L-1?s-1 |
| D、0.8 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨生产过程增大氮气浓度,可以同时提高N2、H2的转化率 |
| B、硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
| C、电解精炼铜时,阳极溶解的金属的质量与阴极析出的金属的质量不相等 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,8 g甲烷(CH4)中含有的碳原子数为2NA |
| B、标准状况下,0.3 mol CO2中含氧原子数为0.3NA |
| C、1 mol Na与足量水反应后转移的电子数为NA |
| D、1 mol?L-1MgCl2溶液中Cl一离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某晶体固态不导电,水溶液能导电说明该晶体是离子晶体 |
| B、原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 |
| C、区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验 |
| D、任何晶体中,若含有阳离子也一定含有阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
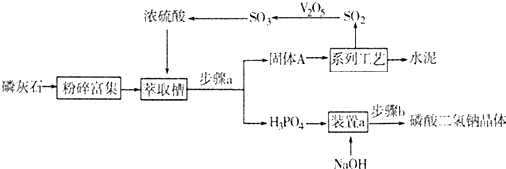
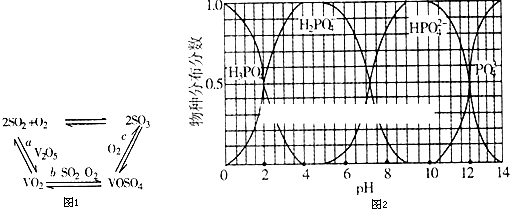
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com