
【题目】下列过程吸收热量的是( )
A.电解水B.氨气液化C.铝热反应D.浓硫酸稀释
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】美国Marchetin博士对世界一次能源替代趋势曾作如下预测.有关说法不正确的是( ) 
A.太阳能、氢能和生物质能等均属于新能源
B.能源物质在提供能量的同时一定有新核素生成
C.天然气与煤炭、石油及薪柴相比,具有热值高、洁净等优势
D.煤、石油及天然气蕴藏的能量来自远古时期生物体所吸收利用的太阳能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g) ![]() 2C(g) ΔH=-192 kJ·mol-1。向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
2C(g) ΔH=-192 kJ·mol-1。向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
![]()
A.若平衡时A气体在两容器中的体积分数相等,则x一定等于y
B.若x∶y=1∶2,则平衡时,M中的转化率:A>B
C.若x∶y=1∶3,当M中放出热量172.8 kJ时,A的转化率为90%
D.若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.36 mol A时,v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“关爱生命,注意安全”。惨痛的天津爆炸触目惊心,火灾之后依然火势绵延不绝的原因之一是易燃物中含有电石。工业上常用电石(主要成分为CaC2,杂质为CaS 等)与水反应生产乙炔气。
(1)工业上合成CaC2主要采用氧热法。
已知:CaO(s)+3C(s)=CaC2(s)+CO(g) △H=+464.1kJ·mol-1
C(s)+l/2 O2(g)=CO(g) △H=-110.5kJ.mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO,为维持热平衡,每生产l molCaC2,转移电子的物质的量为_______。
(2)已知2000℃时,合成碳化钙的过程中还可能涉及到如下反应
CaO(s)+C(s)=Ca(g)+CO(g) K1 △H1=a KJ·mol-1
Ca(g)+2C(s)=CaC2(s) K2 △H2=b KJ·mol-1
2CaO(s)+CaC2(s)=3Ca(g)+2CO(g) K3 △H3=c KJ·mol-1
则K1=_______ (用含K2、K3的代数式表示);c=_____(用含a、b的代数式表示)。
(3)利用电石产生乙炔气的过程中产生的H2S气体制取H2,既廉价又环保。
利用硫化氢的热不稳定性制取氢气。在体积为2L的恒容密闭容器中,H2S起始物质的量为2mol,达到平衡后H2S的转化率![]() 随温度和压强变化如图所示。据图计算T1℃时平衡体系中H2的体积分数_____。由图知压强P1__P2(填“大于”“小于”或“等于”),理由是 ______。
随温度和压强变化如图所示。据图计算T1℃时平衡体系中H2的体积分数_____。由图知压强P1__P2(填“大于”“小于”或“等于”),理由是 ______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷与氯气发生取代反应所得生成物的说法正确的是 ( )
A、都是有机物 B、都不溶于水
C、有一种气态物质,其余都是液体D、有一种是无机物其余都是有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要化工原料,其产量是一个国家石油化工水平的标志.请回答:
(1)乙烯大量用来生产环氧乙烷,生产工艺主要有两种:
【工艺甲】 ![]()
【工艺乙】 ![]()
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应.因此,上述生产工艺中,应采用工艺(填“甲”或“乙”)更环保、更经济.
(2)乙烯为原料还可以合成很多的化工产品.试根据下图回答有关问题: 
Ⅰ、写出物质的化学式:A , B , C .
Ⅱ、写出图示反应②③的化学方程式,并指明反应类型:
②;反应类型: .
③;反应类型: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1mol Cl﹣、ClOX﹣(x=1,2,3,4)的能量(kJ)相对大小如图所示.回答下列问题:
(1)D是(填离子符号).
(2)B→A+C反应的离子方程式为:;生成1molC时, KJ的热(填吸收或放出以及具体数值).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能成功的是
A. 利用酒精萃取溴水中的溴单质
B. 苯和浓溴水反应制取溴苯
C. 加入氢氧化钠溶液以除去乙酸乙酯中的乙酸
D. 用灼烧的方法鉴别棉花和羊毛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【山东省日照市2017届高三下学期第二次模拟考试理科综合化学试题】
以含铅废料(主要含Pb、PbO、PbO2、PbSO4)和稀H2SO4为原料制备高纯Pb、PbO等,实现铅的再生利用。其主要流程如下:

(1)“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4,生成1mol PbSO4,转移电子的物质的量是________mol。Fe2+催化过程可表示为:
①2Fe2++PbO2+4H++SO42-=2Fe3++PbSO4+2H2O
②______________________。(用离子方程式表示反应②)
(2)写出脱硫过程发生主要反应的化学方程式:_______________________________。
(3)已知:①PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)==NaHPbO2(aq),其溶解度曲线如右图所示。
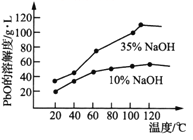
②粗品PbO中所含杂质不溶于NaOH溶液。结合上述信息,完成由粗品PbO得到高纯PbO的操作:将粗品PbO溶解在一定量______(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,_________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)将PbO粗品溶解在HC1和NaC1的混合溶液中,得到含Na2PbC14的电解液,电解Na2PbC14溶液,生成Pb,如右图所示。
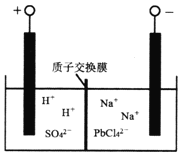
①阴极的电极反应式是__________________________。
②电解一段时间后,Na2PbC14浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com