
【题目】利用反应Cu+2FeCl3=CuCl2+2FeCl2,设计一个原电池。
(1)选用____为负极,___为正极,电解质溶液为_____。
(2)写出电极反应式:负极_____,正极_____。
(3)画出装置图: ______
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列为生活中常用药品:
A.碘酒 B.青霉素 C.阿司匹林
D.葡萄糖注射液 E.抗酸药(主要成分为碳酸氢钠)。
(1)上述药品中属于抗生素的是 _______ (填写字母,下同);
(2)能为人体直接提供能量的是 _______ ;
(3)下列关于药物使用的说法中,正确的是_______。
A.碘酒能使蛋白质变性,常用于外敷消毒
B.长期大量服用阿司匹林可预防疾病,没有毒副作用
C.使用青霉素,可直接静脉注射,不需进行皮肤敏感试验
D.随着平价药房的开设,生病了都可以到药店自己买药服用,不用到医院就诊
(4)碳酸氢钠可防治胃酸分泌过多,其发挥功效时的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一定条件下2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ·mol-1。向甲密闭容器中加入2molSO2和1molO2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同乙容器中加入2molSO3,在相同条件下,达到相同的平衡状态时,吸收的热量为Q2,则下列关系中正确的是( )
2SO3(g) ΔH=-QkJ·mol-1。向甲密闭容器中加入2molSO2和1molO2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同乙容器中加入2molSO3,在相同条件下,达到相同的平衡状态时,吸收的热量为Q2,则下列关系中正确的是( )
A.Q>Q1>Q2B.Q1>Q2>Q
C.Q1>Q>Q2D.Q1=Q2>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某学习小组做Na2O2与H2O反应的实验,发现一些有趣的现象:
①取适量Na2O2固体用脱脂棉包好放在石棉网上,然后向脱脂棉上滴加3-4滴水,结果脱脂棉剧烈燃烧。
②取适量Na2O2固体置于试管中,加水使其充分反应至不再产生气体为止,滴入几滴酚酞试液,溶液先变红后褪色。回答有关问题。
(1)写出Na2O2的电子式_______________________。
(2)已知Na2O2可看作二元弱酸H2O2对应的盐,其第一步水解完全进行。写出其第一步水解的离子方程式为___________________________________。
(3)由①实验现象所得出的有关结论是:a.有氧气生成;b.___________________。
(4)Na2O2与H2O反应的离子方程式____________________________________。
II.为探究Na2O2与H2O反应的机理,他们在老师的指导下设计了下图所示装置。连接好装置,打开K1、K2,通过注射器注入适量蒸馏水,充分反应后用气球鼓气,Na2S溶液变浑浊,酸性KMnO4溶液褪色。分别取A、C中溶液滴入几滴酚酞,开始都变红,以后A中溶液很快褪色,C中溶液缓慢褪色。另取A、C中溶液分别加入少量二氧化锰,充分振荡,发现均反应剧烈、产生大量气泡,把带火星的木条伸入试管,木条复燃,向反应后的溶液中滴入几滴酚酞试液,溶液变红不褪色。

(5)A中冰盐和C中热水的作用分别是__________________,___________________。
(6)用化学方程式表示Na2S变浑浊的原因___________________________________。
(7)用离子方程式表示KMnO4溶液褪色的原因(MnO4-在酸性条件下被还原成Mn2+)__________________________________________。
(8)Na2O2与H2O反应的机理是(用化学方程式表示)第一步_____________________,第二步_______________________________。
(9)若向Na2O2中滴加适量的稀盐酸,也能产生同样的气体,请写出该反应的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究。
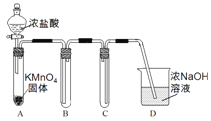
Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适量Cl2,装置B、C的作用分别是___________、_______________。
(2)制得的氯气中加入适量水,得到饱和氯水,饱和氯水中含氯元素的微粒有____________(写出全部微粒)。
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
①滤液漂白性增强的原因是________________(用化学平衡移动原理解释)。
②饱和氯水与石灰石反应生成HC1O的方程式是___________________。
Ⅱ. ClO3—、Cl—和H+反应的探究
(4)KClO3、KCl与硫酸可以反应。该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | (____)mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的_______________________。
②烧杯3取用硫酸的体积应为______________mL。
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列微粒中中心原子的杂化方式和微粒的立体构型均正确的是( )
A.![]() :sp2、平面三角形B.
:sp2、平面三角形B.![]() :sp3、三角锥形
:sp3、三角锥形
C.C2H4:sp 、平面形D.![]() :sp2、V形
:sp2、V形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.60 g SiO2中含Si—O键的个数为4NA
B.12 g金刚石中含有C—C键的个数为NA
C.金属Mg比金属Cu的空间利用率大
D.邻羟基苯甲醛(![]() )比对羟基苯甲醛(
)比对羟基苯甲醛(![]() )的沸点高
)的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照要求回答下列问题:
(1)基态 Cr 原子的价电子排布式为_______,占据最高能层的电子的电子云轮廓图形状为__。
(2)在BF3分子中,硼原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________,写出BF
的立体构型为________,写出BF![]() 的一种等电子体_______。
的一种等电子体_______。
(3)Fe3+比 Fe2+更稳定的原因是_______________________________。
(4)金刚石晶胞中面心和顶点碳原子替换成硅原子即为金刚砂晶胞,其晶胞如图所示:
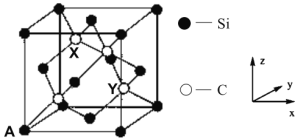
①金刚砂的化学式为_________。
②原子坐标参数表示晶胞内部各原子的相对位置。图中 A 原子坐标(0,0,0),则金刚砂晶胞中碳原子 X 的原子坐标为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为V L的密闭容器中发生化学反应CO(g)+2H2(g) ![]() CH3OH(g),可判断该可逆反应达到化学平衡状态的标志是( )
CH3OH(g),可判断该可逆反应达到化学平衡状态的标志是( )
A. v生成(CH3OH)=v消耗(CO) B. CO、H2、CH3OH的浓度比为1:2:1
C. 混合气体的密度不再改变 D. 混合气体的平均相对分子质量不再改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com