
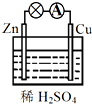
| A. | Cu为正极,SO42+向正极移动 | B. | 电子由铜片通过导线流向锌片 | ||
| C. | 该装置能将电能转化为化学能 | D. | 正极反应为 2H++2e-═H2↑ |
分析 锌、铜和稀硫酸组成的原电池中,锌作负极,负极上锌失电子发生氧化反应;铜作正极,正极上氢离子得电子发生还原反应;电子从负极沿导线流向正极;原电池中化学能转化为电能.
解答 解:A、锌、铜和稀硫酸组成的原电池中,锌作负极,铜作正极,SO42+向负极移动,故A错误;
B、锌、铜和稀硫酸组成的原电池中,锌作负极,铜作正极,电子从负极沿导线流向正极,即电子由锌片通过导线流向铜片,故B错误;
C、Zn、Cu、硫酸构成原电池,实现了化学能转化为电能,故C错误;
D、锌、铜和稀硫酸组成的原电池中,铜作正极,正极上氢离子得电子发生还原反应为2H++2e-=H2↑,故D正确;
故选D
点评 本题考查学生原电池的工作原理,注意把握正负极的判断、电极方程式的书写、电子流向等,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 乙醇和乙酸都是常用调味品的主要成分,它们在一定条件下都可以发生取代反应 | |
| C. | 分子式为C4H9Cl的同分异构体共有4种(不考虑立体异构) | |
| D. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图为元素周期表截取的短周期的一部分,四种元素均不是稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表截取的短周期的一部分,四种元素均不是稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | z的最高正化合价与最低负化合价的绝对值可能相等 | |
| D. | w的最高价氧化物的水化物可能为弱酸,也有可能为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaO2、NaCl、LiH 三种物质阳离子与阴离子个数比均为:1:1 | |
| B. | CCl4、NH3、PCl3中所有原子都满足最外层为8电子结构 | |
| C. | 甲烷可与溴水发生取代反应,乙烯可与溴水发生加成反应 | |
| D. | 燃料电池是通过燃烧所释放的热能再转化为电能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C | |
| B. | 碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na | |
| C. | 离子半径:Na+>Mg2+>Al3+>Cl-;原子半径:Na>Mg>Al>Cl | |
| D. | 稳定性:HF>H2O>NH3>CH4; 还原性:CH4>NH3>H2O>HF |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者都能形成酸雨 | B. | 两者都能与NaOH溶液反应 | ||
| C. | 两者都既有氧化性,又有还原性 | D. | 两者与水反应都生产强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | C-C | C═C | C-H | H-H |
| 键能/(kJ•mol-1) | 348 | 610 | 413 | 436 |
 (g)+3H2(g)→
(g)+3H2(g)→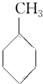 (g)的反应热;
(g)的反应热;| A. | ①②③④ | B. | ③④⑤ | C. | ④⑤ | D. | ⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com