
在0.5 L 1 mol/L 氯化铁溶液和0.2 L 2 mol/L氯化钾溶液中,氯离子的浓度之比是
A.15︰4 B.5︰4 C.5︰2 D.3︰2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| X | |||
| Y | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp表示。
即:AmBn(s) mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
已知:某温度时,Ksp(AgCl)=[Ag+][Cl-] =1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO2- 4] =1.1×10-12
1.81/2=1.3 2751/3=6.5
试求:
(1)此温度下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度,并比较两者的大小。
(2)此温度下,在0.010mo1·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度,并比较两者的大小。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年辽宁省师大附中高二下学期期中考试化学试卷 题型:计算题
一定温度下,难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp表示。
即:AmBn(s)  mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
已知:某温度时,Ksp(AgCl)=[Ag+][Cl-] =1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO2- 4] =1.1×10-12
1.81/2="1.3 " 2751/3=6.5
试求:
(1)此温度下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度,并比较两者的大小。
(2)此温度下,在0.010mo1·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度,并比较两者的大小。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省内江市高三第二次模拟考试理综化学试卷(解析版) 题型:推断题
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1 : 1的化合物N是常见的有机溶剂。
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为______,E的基态原子的外围电子排布式为______。
(2)B、C、D三种元素的第一电离能由小到大的顺序为______。
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为______
(4)下列叙述正确的是______(填序号)。
a. M是极性分子,N是非极性分子 b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键 d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5) 已知:①E的一种氧化物Q,其晶胞结构如图所示
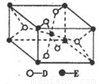
①Q(s)+2Cl2(g)=ECl4(l)+D2(g) △H=+140kJ/mol
②2B(s)+D2(g)=2BD(g) △H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:__________________________
(6)在0.5 L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g) +3 A2(g)=2CA3(g) △H <0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。

①试比较K1,K2的大小,K1________K2(填写“ >”、“=”或“<”)。
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1 mol、2 mol时,则该反应的 V(C2)正_________(C2)逆(填写“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2012届辽宁省高二下学期期中考试化学试卷 题型:计算题
一定温度下,难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp表示。
即:AmBn(s)  mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
已知:某温度时,Ksp(AgCl)=[Ag+][Cl-] =1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO2- 4] =1.1×10-12
1.81/2=1.3 2751/3=6.5
试求:
(1)此温度下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度,并比较两者的大小。
(2)此温度下,在0.010mo1·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度,并比较两者的大小。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com