
下列离子方程式正确的是
A.Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+=SO42-+3S↓+H2O
B.磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3- 9Fe3++NO↑+14H2O
9Fe3++NO↑+14H2O
C.100ml0.1mol/L FeI2溶液与标况下0.224L Cl2: 2Fe2++ Cl2=2Fe3++2Cl-
D.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:
2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
若NA表示阿佛加德罗常数,下列说法正确的是( )
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.14g氮气中含有7NA个电子
C.在25℃,101kPa时,22.4L氢气中含有2NA个氢原子
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7 :4
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式______________________
(2)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式_____________________________________________
⑶洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。 漂白粉是常用的消毒剂。工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
______________________________________________________
⑷ 在下图的四条直线分别表示钠、铜、铝、铁与足量Cl2反应时,消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是________,如果横轴表示消耗掉的硫的质量,则b表示的是四种金属中的______________

⑸硫酸铜溶液与碘化钾溶液反应,生成一种能使淀粉溶液变蓝的单质和一种含有两种元素的物质,当有0.5molCuSO4参加反应时转移电子数为3.01×1023,写出符合此反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.配制FeCl3溶液,可将一定量FeCl3固体溶于适量盐酸中并加入少量铁粉
B.制备Fe(OH)3胶体,可向沸水中滴加FeCl3饱和溶液并长时间煮沸
C.配制0.1 mol·L-1 NaOH溶液100 mL,将4.0 g NaOH固体放入100 mL容量瓶中溶解
D.向饱和Ca(OH)2溶液中加入少量无水CaO固体,恢复原温度,溶液中Ca(OH)2的物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析。具体步骤如下图所示:


①加入试剂a后发生反应的离子方程式为 。
②操作b为 ,操作c为 。
③Al(NO3)3待测液中,c (Al3+) = mol·L-1(用m、v表示)。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:

①根据下表数据,请你判断该电池工作的适宜温度应控制在 范围内(填字母序号)。
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
a.100℃以下 b.100℃~300℃ c. 300℃~350℃ d. 350℃~2050℃
②放电时,电极A为 极。
③放电时,内电路中Na+的移动方向为 (填“从A到B”或“从B到A”)。
④充电时,总反应为Na2Sx === 2Na + xS(3<x<5),则阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
A. 连接全部仪器,使其成为如图装置,并检查装置的气密性。
B. 称取研细的辉铜矿样品1.000g。
C. 将称量好的样品小心地放入硬质玻璃管中。
D. 以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2 +2Cu。
F. 移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
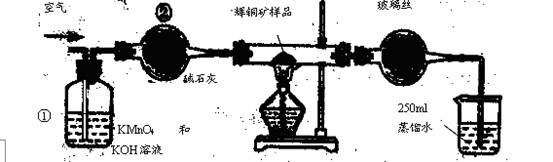
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为 ,当产生______________________________ _的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中由一个明显的缺陷影响了测定结果(不属于操作失误),你认为是
(写一种既可)。
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系: c2 (H+) ·(S2-) = 1 . 0×10-22 。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定的溶液中一定能大量共存的是
A.加入铝产生H2的溶液:NO3-、NH4+、Ba2+、Cl-、Na+
B.使酚酞变红的色的溶液:Na+、Cu2+、HCO3-、NO3-
C.0.1 mol/L的FeCl3溶液:Ba2+、NO3-、Na+、Cu2+、I-
D.0.1 mol/L的NH4Cl溶液:K+、Na+、HCO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下图:

(1)电解精练银时,阴极反应式为_______________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该红棕色气体与水反应的化学方程式为_______________________________________。
(2)固体混合物B的组成为_____________;在生成固体B的过程中,必须控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为_____________________。
(3)煅烧过程中生成的氧化产物与NH3在催化剂条件下反应的化学方程式为_____________________。这个反应中会有白烟产生,该白烟为______________。
(4)若银铜合金中铜的质量分数为64%,理论上3.0kg废料中的铜可完全转化为__________molCuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液___________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
在通常条件下,下列各组物质的性质排列正确的是 ( )
A.熔点: B.结合质子能力: Cl->CH3COO-> OH-
B.结合质子能力: Cl->CH3COO-> OH-
 C.沸点:乙烷>戊烷>丁烷 D.热稳定性:
C.沸点:乙烷>戊烷>丁烷 D.热稳定性: 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com