
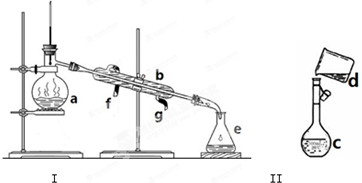
 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.| m |
| M |


科目:高中化学 来源: 题型:
| A、前20 min的平均反应速率v(C)=0.1 mol/(L?min) |
| B、A的转化率为50% |
| C、C的平衡浓度c(C)=4 mol/L |
| D、B的平衡浓度c(B)=1.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 +R
+R| 一定条件 |
| 反应① |
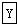 +R
+R| 一定条件 |
| 反应② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50 mL 0.55 mol?L-1 NaOH溶液 | 50 mL 0.5 mol?L-1 HCl溶液 | 20℃ | 23.3℃ | |
| ② | 50 mL 0.55 mol?L-1 NaOH溶液 | 50 mL 0.5 mol?L-1 HCl溶液 | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4C1溶液中,溶质物质的量浓度大小关系是:c(NH4Cl)>c[(NH4)2SO4]>c[(NH4)2Fe(SO4)2] |
| B、已知25℃时Ksp(AgCl)=1.8×10-10,则在0.1 mol?L-l A1Cl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol?L-l |
| C、25℃时0.2 mol?L-l HC1溶液与等体积0.05 mol?L-l Ba(OH)2溶液混合后,溶液的pH约为1 |
| D、0.1mol?L-l NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(A2-)>c(H2A) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com