

| | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀 | 2.1 | 3.7 | 9.0 |
| 沉淀完全 | 3.2 | 5.2 | 12.4 |
 NH3·H2O+H+,MgO+ 2H+=Mg2++H2O,氧化镁消耗氢离子,铵根离子水解平衡向右进行,不断提供H+使MgO不断溶解(3分)(写出两个方程式就给2分,平衡向右移动给1分)
NH3·H2O+H+,MgO+ 2H+=Mg2++H2O,氧化镁消耗氢离子,铵根离子水解平衡向右进行,不断提供H+使MgO不断溶解(3分)(写出两个方程式就给2分,平衡向右移动给1分) NH3?H2O+H+,氧化镁与氢离子反应,生成镁离子和水,减小氢离子浓度,促进铵根离子的水解平衡右移,生成的氢离子又溶解菱镁矿粉粹后加热生成的氧化镁;(2)步骤③生成硫酸铵,步骤②消耗硫酸铵,说明该工艺流程中,硫酸铵是可以循环利用的物质;(3)配制250mL溶液需要的玻璃仪器是烧杯、玻璃棒、250mL容量瓶、胶头滴管、酸式滴定管等;氨气和硫酸反应所得溶液中含有H+、NH4+、OH-,根据电荷守恒原理可得:c(H+)+c(NH4+)=2c(SO42ˉ),由于pH=1,则溶液中c(H+)=0.1mol/L,c(SO42ˉ)=1.05mol/L,所以c(NH4+)=2.0mol/L;由于(NH4)2SO4=2NH4++SO42ˉ,则没有水解时c(NH4+)="2" c(SO42ˉ)=2.1mol/L;由三行数据法得:
NH3?H2O+H+,氧化镁与氢离子反应,生成镁离子和水,减小氢离子浓度,促进铵根离子的水解平衡右移,生成的氢离子又溶解菱镁矿粉粹后加热生成的氧化镁;(2)步骤③生成硫酸铵,步骤②消耗硫酸铵,说明该工艺流程中,硫酸铵是可以循环利用的物质;(3)配制250mL溶液需要的玻璃仪器是烧杯、玻璃棒、250mL容量瓶、胶头滴管、酸式滴定管等;氨气和硫酸反应所得溶液中含有H+、NH4+、OH-,根据电荷守恒原理可得:c(H+)+c(NH4+)=2c(SO42ˉ),由于pH=1,则溶液中c(H+)=0.1mol/L,c(SO42ˉ)=1.05mol/L,所以c(NH4+)=2.0mol/L;由于(NH4)2SO4=2NH4++SO42ˉ,则没有水解时c(NH4+)="2" c(SO42ˉ)=2.1mol/L;由三行数据法得: NH3?H2O+H+
NH3?H2O+H+ =
= =5.00×10-3 mol?Lˉ1;
=5.00×10-3 mol?Lˉ1; NH3·H2O+H+,再写Fe2O3+6H+=2Fe3++3H2O,前者×6+后者可得:Fe2O3+6NH4++3H2O=6NH3·H2O+2Fe3+,加热时6NH3·H2O
NH3·H2O+H+,再写Fe2O3+6H+=2Fe3++3H2O,前者×6+后者可得:Fe2O3+6NH4++3H2O=6NH3·H2O+2Fe3+,加热时6NH3·H2O  6NH3+6H2O,则Fe2O3+6NH4+=6NH3↑+2Fe3++3H2O;(5)蒸发结晶得到的目标产物是MgSO4·7H2O,加热温度过低,蒸发结晶速率过低,加热温度过高,结晶析出的MgSO4·7H2O失去部分或全部的结晶水,因此蒸发结晶过程中需要使用60~70℃水浴加热方式。
6NH3+6H2O,则Fe2O3+6NH4+=6NH3↑+2Fe3++3H2O;(5)蒸发结晶得到的目标产物是MgSO4·7H2O,加热温度过低,蒸发结晶速率过低,加热温度过高,结晶析出的MgSO4·7H2O失去部分或全部的结晶水,因此蒸发结晶过程中需要使用60~70℃水浴加热方式。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
| B.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| C.因为H2SO4是强酸,所以反应:CuSO4十H2S=CuS↓+H2SO4不能发生 |
| D.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 。若某氢氧化镁溶液的PH=9,则该溶液中c(Mg2+)最大为
。若某氢氧化镁溶液的PH=9,则该溶液中c(Mg2+)最大为| A.0.18mol/L | B.1.8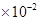 mol/L mol/L | C.1.8 mol/L mol/L | D.2.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CaSO4是一种强酸弱碱盐 |
| B.CaSO4溶解度小于CaCO3 |
| C.CaSO4溶解度大于CaCO3 |
| D.CaSO4溶解度等于CaCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.x的数值为2×10-5 |
| B.c点时有碳酸钙沉淀生成 |
| C.b点与d点对应的溶度积相等 |
| D.加入蒸馏水可使溶液由d点变到a点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++A2- 完成以下问题:
H++A2- 完成以下问题: CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K= (计算结果保留三位有效数字)
CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K= (计算结果保留三位有效数字)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
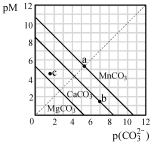
| A.MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B.a 点可表示MnCO3的饱和溶液,且c(Mn2+)= c(CO32-) |
| C.b 点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D.c 点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO32-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuS易水解 |
| B.CuS可溶于盐酸 |
| C.相同温度下氢硫酸饱和溶液中硫离子(S2-)浓度比CuS饱和溶液中大 |
| D.强酸可以制取弱酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向饱和AgCl水溶液中加入饱和NaCl溶液,c(Cl-)增大,AgCl的溶度积增大 |
| B.将难溶电解质放入纯水中,溶解达平衡时,电解质离子的浓度的乘积就是该物质的溶度积 |
| C.向含有AgCl固体的溶液中加入适量的水使AgCl溶解,重新达到平衡时,AgCl的溶度积不变,其溶解度也不变 |
| D.AgCl的Ksp=1.8×10-10mol2·L-2,则在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10mol2·L-2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com