
| A. | 该元素位于元素周期表的第三周期ⅦA族 | |
| B. | 生成的盐含有的化学键既有离子键又有共价键 | |
| C. | 该元素的常见化合价有:-1、0、+1、+3、+5、+7等 | |
| D. | 该元素的氢化物的稳定性比PH3、H2S弱 |
分析 某短周期元素的气态氢化物与该元素最高价氧化物对应的水化物反应生成盐,该元素为氮元素,
A.周期数=电子层数、主族族序数=最外层电子数;
B.铵盐为离子化合物,含有离子键和共价键;
C.氮元素常见化合价有:-3、0、+1、+2、+3、+4、+5;
D.非金属性越强氢化物越稳定.
解答 解:某短周期元素的气态氢化物与该元素最高价氧化物对应的水化物反应生成盐,该元素为氮元素,
A.氮元素原子核外有2个电子层,最外层电子数为5,处于第二周期数第ⅤA族,故A错误;
B.铵盐为离子化合物,含有离子键和共价键,如硝酸铵、氯化铵等,故B正确;
C.氮元素常见化合价有:-3、0、+1、+2、+3、+4、+5,故C错误;
D.非金属性N>P,N>S,故氨气的稳定性比PH3、H2S强,故D错误;
故选B.
点评 本题考查结构性质位置关系、元素周期律等,为高频考点,把握元素的位置、元素的性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
| A | 2.0 | 1.0 | 0 |
| B | 1.0 | 0 | 1.0 |
| C | 0.20 | 0.10 | 1.80 |
| D | 0 | 0 | 2.0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
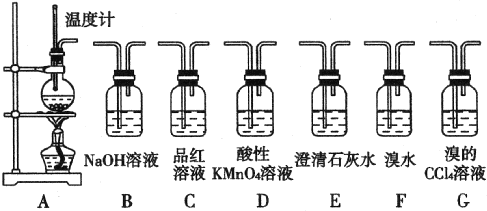
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑥ | B. | ①⑥ | C. | ①④⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大O2的浓度可以提高反应速率和SO2的转化率 | |
| B. | 使用催化剂可以提高SO2的转化率 | |
| C. | 反应在450℃时的平衡常数小于500℃时的平衡常数 | |
| D. | 2moLSO2(g)和1moLO2(g)所含的总能量小于2moLSO3(g)所含的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | ⅢA | ⅣA | VA | VIA | VIIA | 0 |
| ① | ② | ③ | ||||||
| ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
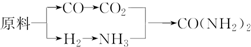
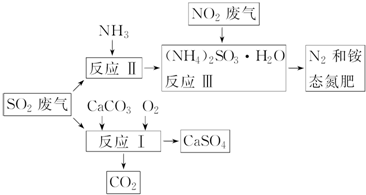
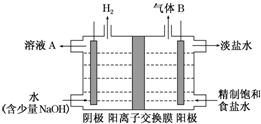
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com