
在一定条件下,1 mol某气体若被O2完全氧化放热98.0 kJ,现有2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为
(注:某反应物的转化率=该反应物转化(消耗)的物质的量÷该反应物起始的物质的量×100%)
科目:高中化学 来源: 题型:
 有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻
有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
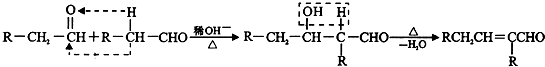

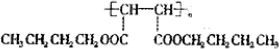
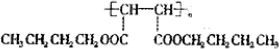
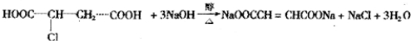
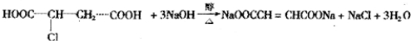
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
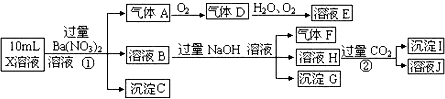
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)图瓦卢是由多个珊瑚礁形成的岛国。由于大气中CO2含量的剧增,大量珊瑚礁(主要成分是碳酸钙)被海水侵蚀,其原因是(用化学方程式表示) _______________________________。
(2)温室效应导致海平面上升,引起温室效应的人为原因主要是 _____________________。
(3)为了控制温室效应,各国科学家提出了不少方法和设想。有人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底,以减小大气中CO2的浓度。为使CO2液化,可采用的措施是( )
A.减压、升温 B.增压、升温
C.减压、降温 D.增压、降温
(4)科学家致力于二氧化碳的“组合转化”技术研究,把过多的二氧化碳转化为有益于人类的物质。如将CO2和H2以1∶4的比例混合,通入反应器。在适当的条件下反应,可获得一种重要的能源。请完成以下化学方程式:CO2+4H2![]() ( )+2H2O
( )+2H2O
若将CO2与H2混合,在一定条件下以1∶3的比例发生反应,生成某种重要的化工原料和水。该化工原料可能是( )
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
(5)有效地减缓大气中CO2大量增加的生态学措施是( )
A.使用天然气等燃料 B.控制全球人口增长
C.植树造林,保护森林 D.立即减少煤和石油的燃烧
查看答案和解析>>
科目:高中化学 来源:期末题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com