
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.77×10-4 | 4.9×10-16 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 2HCOOH+CO32-═2HCOO-+H2O+CO2↑ | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 | |
| D. | HCOOH+CN-═HCOO-+HCN |
分析 A.强酸能和弱酸盐反应生成弱酸;
B.强酸能和弱酸盐反应生成弱酸;
C.中和酸需要碱的物质的量与酸的物质的量、酸的元数成正比,等pH、等体积的HCOOH和HCN,n(HCN)>n(HCOOH);
D.相同条件下,酸的电离平衡常数越大,其电离程度越大,则其酸性越强.
解答 解:A.酸性强弱顺序是HCOOH>H2CO3>HCN>HCO3-,强酸能和弱酸盐反应生成弱酸,所以反应方程式为CN-+H2O+CO2=HCN+HCO3-,故A错误;
B.酸性强弱顺序是HCOOH>H2CO3>HCN>HCO3-,强酸能和弱酸盐反应生成弱酸,所以反应方程式为2HCOOH+CO32-=2HCOO-+H2O+CO2↑,故B正确;
C.等pH、等体积的HCOOH和HCN,n(HCN)>n(HCOOH),中和酸需要碱的物质的量与酸的物质的量、酸的元数成正比,所以中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故C正确;
D.同条件下,酸的电离平衡常数越大,其电离程度越大,则其酸性越强,根据电离平衡常数知,酸性强弱顺序是HCOOH>H2CO3>HCN>HCO3-,HCOOH+CN-═HCOO-+HCN,反应符合酸性强弱,故D正确;
故选A.
点评 本题考查了弱电解质的电离,明确弱电解质电离平衡常数与酸性强弱、酸根离子的水解程度的关系是解本题关系,再结合强酸制取弱酸、酸碱中和反应来分析解答,易错选项是C,和酸反应需要碱的量与电解质强弱无关,为易错点,题目难度中等.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷和乙烯:分别通入酸性KMnO4溶液 | |
| B. | 苯和四氯化碳:分别与水混合、振荡、静置 | |
| C. | 乙醇和乙酸:分别滴加NaOH溶液 | |
| D. | 棉花织品和羊毛织品:分别燃烧闻气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 13 | C. | 3 | D. | 11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用铝热反应制得单质镁 | |
| B. | 从海带中提取碘常用过氧化氢做还原剂 | |
| C. | 水华、赤潮等水体污染是由于含氮、磷的大量污水任意排放造成的 | |
| D. | 铝热剂就是指铝和氧化铁混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛 | B. | 3-甲基丁醛 | C. | 已醛 | D. | 丁醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
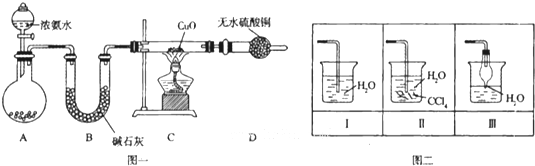
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 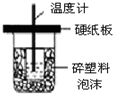 如图装置用于中和热的测定 | |
| B. | 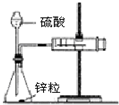 如图装置用于测定氢气的反应速率(单位mL/s) | |
| C. | 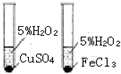 如图装置用于研究催化剂Cu2+和Fe3+对反应速率的影响 | |
| D. |  如图装置用于已知浓度的高锰酸钾溶液测定未知浓度的草酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
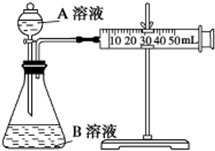 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4酸性溶液 |
| ② | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4酸性溶液 |
| ③ | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4酸性溶液和少量MnSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com