
【题目】甲酸(化学式HCOOH,分子式CH2O2,相对分子质量46),俗名蚁酸,是最简单的羧酸,无色而有刺激性气味的易挥发液体。熔点为8.6 ℃,沸点100.8℃,25℃电离常数Ka=1.8×10-4。某化学兴趣小组进行以下实验。
Ⅰ.用甲酸和浓硫酸制取一氧化碳
A. 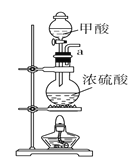 B.
B. 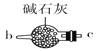 C.
C. 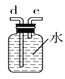 D.
D. 
(1)请说出图B中盛装碱石灰的仪器名称__________。用A图所示装置进行实验。利用浓硫酸的脱水性,将甲酸与浓硫酸混合,甲酸发生分解反应生成CO,反应的化学方程式是________;实验时,不需加热也能产生CO,其原因是_______。
(2)如需收集CO气体,连接上图中的装置,其连接顺序为:a→__________(按气流方向,用小写字母表示)。
Ⅱ.对一氧化碳的化学性质进行探究
资料:ⅰ.常温下,CO与PdCl2溶液反应,有金属Pd和CO2生成,可用于检验CO;
ⅱ.一定条件下,CO能与NaOH固体发生反应:CO+NaOH![]() HCOONa
HCOONa
利用下列装置进行实验,验证CO具有上述两个性质。
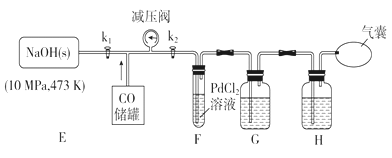
(3)打开k2,F装置中发生反应的化学方程式为_____________;为了使气囊收集到纯净的CO,以便循环使用,G装置中盛放的试剂可能是_________,H装置的作用是____________。
(4)现需验证E装置中CO与NaOH固体发生了反应,某同学设计下列验证方案:取少许固体产物,配置成溶液,在常温下测该溶液的pH,若pH>7,证明CO与NaOH固体发生了反应。该方案是否可行,请简述你的观点和理由:________,_________。
(5)25℃甲酸钠(HCOONa)的水解平衡常数Kh的数量级为____________。若向100ml 0.1mol.L-1的HCOONa溶液中加入100mL0.2mol.L-1的HCl溶液,则混合后溶液中所有离子浓度由大到小排序为_________。
【答案】球形干燥管 HCOOH CO↑+H2O 浓硫酸与甲酸混合时放出大量的热 c→b→e→d→f PdCl2+CO+H2O=Pd↓+CO2+2HCl 氢氧化钠溶液 除去CO中水蒸气 方案不可行 无论CO与NaOH固体是否发生反应,溶液的pH均大于7 10-11 c(Cl-)>c(H+)>c(Na+)>c(HCOO-)>c(OH-)
CO↑+H2O 浓硫酸与甲酸混合时放出大量的热 c→b→e→d→f PdCl2+CO+H2O=Pd↓+CO2+2HCl 氢氧化钠溶液 除去CO中水蒸气 方案不可行 无论CO与NaOH固体是否发生反应,溶液的pH均大于7 10-11 c(Cl-)>c(H+)>c(Na+)>c(HCOO-)>c(OH-)
【解析】
A装置利用浓硫酸的脱水性制备CO,生成的CO中含有挥发出的甲酸气体,需要利用碱石灰除去甲酸,利用排水法收集CO,结合物质的性质和装置分析解答。
Ⅰ.(1)图B中盛装碱石灰的仪器名称是球形干燥管。用A图所示装置进行实验。利用浓硫酸的脱水性,将甲酸与浓硫酸混合,甲酸发生分解反应生成CO,根据原子守恒可知反应的化学方程式是HCOOH CO↑+H2O。由于浓硫酸与甲酸混合时放出大量的热,所以实验时,不需加热也能产生CO。
CO↑+H2O。由于浓硫酸与甲酸混合时放出大量的热,所以实验时,不需加热也能产生CO。
(2)根据以上分析可知如需收集CO气体,连接上图中的装置,其连接顺序为:a→c→b→e→d→f。
Ⅱ.(3)打开k2,由于常温下,CO与PdCl2溶液反应,有金属Pd和CO2生成,则F装置中发生反应的化学方程式为PdCl2+CO+H2O=Pd↓+CO2+2HCl;由于F装置中有二氧化碳和氯化氢生成,且二者都是酸性气体,则为了使气囊收集到纯净的CO,以便循环使用,G装置中盛放的试剂可能是氢氧化钠溶液。剩余的CO中还含有水蒸气,则H装置的作用是除去CO中水蒸气。
(4)由于无论CO与NaOH固体是否发生反应,溶液的pH均大于7,所以该方案不可行;
(5)25℃甲酸电离常数Ka=1.8×10-4,则25℃甲酸钠(HCOONa)的水解平衡常数Kh=![]() ,其数量级为10-11。若向100mL 0.1mol·L-1的HCOONa溶液中加入100mL 0.2mol·L-1的HCl溶液,反应后溶液中含有等物质的量浓度的甲酸、氯化钠、氯化氢,则混合后溶液中所有离子浓度由大到小排序为c(Cl-)>c(H+)>c(Na+)>c(HCOO-)>c(OH-)。
,其数量级为10-11。若向100mL 0.1mol·L-1的HCOONa溶液中加入100mL 0.2mol·L-1的HCl溶液,反应后溶液中含有等物质的量浓度的甲酸、氯化钠、氯化氢,则混合后溶液中所有离子浓度由大到小排序为c(Cl-)>c(H+)>c(Na+)>c(HCOO-)>c(OH-)。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案科目:高中化学 来源: 题型:
【题目】一种浓差电池如图所示,阴、阳离子交换膜交替放置,中间的间隔交替充以河水和海水,选择性透过Cl和Na+,在两电极板形成电势差,进而在外部产生电流。下列关于该电池的说法正确的是( )
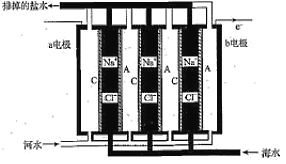
A.a电极为电池的正极,电极反应为2H++2e═H2↑
B.C为阴离子交换膜,A为阳离子交换膜
C.负极隔室的电中性溶液通过阳极表面的还原作用维持
D.该电池的缺点是离子交换膜价格昂贵,优点是电极产物有经济价值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物H(阿戈美拉汀)是一种抗抑郁药,H的一种合成路线如下:

已知:![]()
![]()
![]() ;化合物B中含五元环结构,化合物E中含两个六元环状结构。
;化合物B中含五元环结构,化合物E中含两个六元环状结构。
回答下列问题:
(1)A的名称为_______
(2)H中含氧官能团的名称为_______
(3)B的结构简式为_______
(4)反应③的化学方程式为_______
(5)⑤的反应类型是_______
(6)M是C的一种同分异构体,M分子内除苯环外不含其他的环,能发生银镜反应和水解反应,其核磁共振氢谱有4组峰且峰面积之比为6:3:2:1。任写出三种满足上述条件的M的结构简式_______(不考虑立体异构)。
(7)结合上述合成路线,设计以2—溴环己酮( ) 和氰基乙酸(NCCH2COOH)为原料制备
) 和氰基乙酸(NCCH2COOH)为原料制备![]() 的合成路线_______(无机试剂及有机溶剂任选)
的合成路线_______(无机试剂及有机溶剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙基香兰素(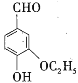 )广泛应用于食品及日用化妆品中,起增香和定香作用,下列关于乙基香兰素的说法错误的是( )
)广泛应用于食品及日用化妆品中,起增香和定香作用,下列关于乙基香兰素的说法错误的是( )
A.乙基香兰素的分子式为C9H10O3B.乙基香兰素与苯甲醛互为同系物
C.乙基香兰素的同分异构体可能含有酯基D.乙基香兰素能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据系统命名法,天然橡胶应称为聚![]() 甲基
甲基![]() ,
,![]() 丁二烯,其结构简式为
丁二烯,其结构简式为![]() ,单体为
,单体为![]() 甲基
甲基![]() ,
,![]() 丁二烯。该反应的化学方程式为n
丁二烯。该反应的化学方程式为n![]()
![]()
![]() 。合成橡胶就是根据以上原理制成的。
。合成橡胶就是根据以上原理制成的。
(1)以![]() 为单体可生成氯丁橡胶,试写出该反应的化学方程式:_______。
为单体可生成氯丁橡胶,试写出该反应的化学方程式:_______。
(2)丁腈橡胶的结构简式为![]() ,形成该橡胶的单体为_____。
,形成该橡胶的单体为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,室温下为不稳定的黄色气体, 具刺鼻恶臭味,遇水分解,某学习小组用 C12 和 NO 制备 NOCl 装置如图。下列说法错误的是
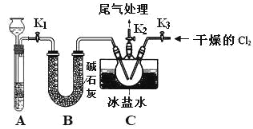
A.氯气在反应中做氧化剂
B.装入药品后,要先打开 K2、K3,反应一段时间后,再打开 K1
C.利用 A 装置还可以做 Na2O2 和水制氧气的实验
D.若没有 B 装置,C 中可能发生反应:2NOCl+H2O=2HCl+NO↑+NO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素M的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为________。
(2)硫酸铝溶液与过量氨水反应的离子方程式为_______________________________。
(3)能证明Na2SO3溶液中存在SO32-+H2OHSO3-+OH-水解平衡的事实是________(填序号)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
(4)某学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂。盛装0.2000 mol/L盐酸标准液应该用______________式滴定管;用盐酸滴定待测液NaOH,滴定终点时的颜色变化是_____________且30s不变色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出化学反应方程式:
(1)在苯酚与水的浊液中加入氢氧化钠溶液后变澄清:_________________;
(2)乙醛与新制备的氢氧化铜反应,产生砖红色沉淀:_________________;
(3)乙醇的催化氧化:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比 pH 的定义,对于稀溶液可以定义pC(X)=-lg c(X),pKa=-lg Ka,常温下,某浓度 H2A 溶液在不同 pH 下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示,下列说法正确的是

A.随着 pH 的增大,pC 增大的曲线是 A2-的物质的量浓度的负对数
B.pH=3.50 时,c(HA-)>c(A2-)>c(H2A)
C.b 点时, =104.50
=104.50
D.pH=3.00~5.30 时,c(H2A)+c(HA-)+c(A2-)先减小后增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com