
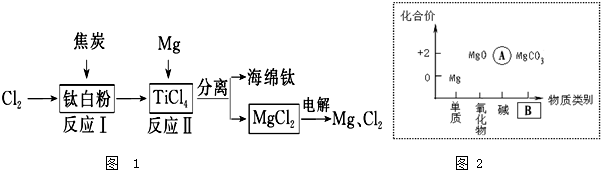
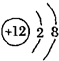 为镁元素的某种粒子结构示意图,该图表示(填序号)
为镁元素的某种粒子结构示意图,该图表示(填序号)
| ||
| ||
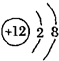 为镁离子的结构示意图,说明镁是一种活泼金属,易失去电子;
为镁离子的结构示意图,说明镁是一种活泼金属,易失去电子;
| ||
| ||
 为镁离子的结构示意图,说明镁是一种活泼金属,易失去电子,故答案为:C;活泼;
为镁离子的结构示意图,说明镁是一种活泼金属,易失去电子,故答案为:C;活泼;
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.| 物质 | 沸点/℃ |
| 三苯甲醇 | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
| ①操作 |
| ②溶解、过滤 |
| ③洗涤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
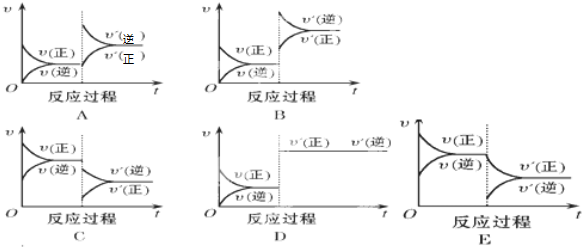
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 |  选用滴定管 选用滴定管 |
| A | 碱 | 酸 | 石芯 | (乙) |
| B | 酸 | 碱 | 酚酞 | (甲) |
| C | 碱 | 酸 | 甲基橙 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
| 实验 编号 | 待测氢氧化钠溶液体积(mL) | 滴定开始读数(mL) | 滴定结束读数(mL) | 消耗盐酸体积(mL) |
| ① | 25.00 | 0.02 | 26.40 | |
| ② | 25.00 | 0.04 | 25.81 | |
| ③ | 25.00 | 0.03 | 25.78 | |
| ④ | 25.00 | 0.20 | 25.96 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
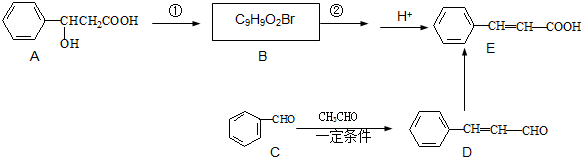
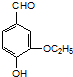 是有机物A的同分异构体,下列说法错误的是
是有机物A的同分异构体,下列说法错误的是查看答案和解析>>
科目:高中化学 来源: 题型:
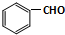
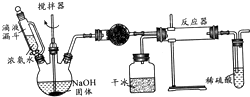 实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.
实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.查看答案和解析>>
科目:高中化学 来源: 题型:
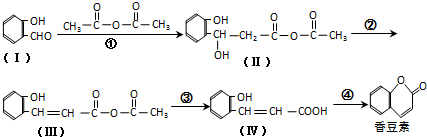
 与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为
与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
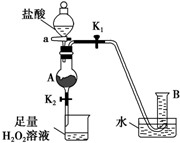 如图装置(夹持装置略,气密性已检验)某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体,下列推断不合理的是( )
如图装置(夹持装置略,气密性已检验)某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体,下列推断不合理的是( )| A、B中收集到的气体是氢气 |
| B、烧杯中双氧水溶液作用是将Fe2+还原为Fe3+ |
| C、A中的氧化铁与盐酸反应生成氯化铁 |
| D、烧杯中溶液在氯化氢气氛下,蒸发浓缩、冷却结晶、过滤后得到氯化铁晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com