
已知两种弱酸的酸性:HA>HB,在常温下下列各项比较中正确的是
A.等物质的量浓度的HA溶液与NaB溶液等体积的混合液中:
2c(Na+) =c(A-)+c(B-)+c(HA)+c(HB)
B.pH相等的NaA与KB两溶液中:[c(Na+)-c(A-)] < [c(K+)-c(B-)]
C.pH=9的三种溶液 ①NaB ②NH3·H2O ③NaOH中由水电离出的c(OH-):①>②>③
D. 两种溶液① 0.1mol/L HA溶液 ②0.1mol/L HB溶液,加水稀释至pH 相同,需加水的量前者小于后者
科目:高中化学 来源: 题型:
常温下有浓度均为0.5mol/L的四种溶液:①Na2CO3;②NaHCO3;③HCl;④NH3·H2O。
(1)上述溶液中,可发生水解的是________(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为________________________________________。
(3)向溶液④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填“增大”、“减小”、“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”、“等于”),此时溶液中离子浓度由大到小的顺序是______________________。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机化合物的结构与碳原子的成键方式有关。碳原子的结构特点决定了它与另外的原子结合时以形成共价键为主。下列说法正确的 ( )
①依据成键原子间共用电子的对数可将共价键分为单键、双键、叁键
②依据共用电子是否偏向于某一成键原子,可将共价键分为极性键和非极性键
③碳原子不仅彼此间可以成键,还可以与其他元素的原子成键
④碳原子成键方式的多样性使得有机化合物普遍存在着同分异构现象,常见的同分异构有碳骨架异构、官能团位置异构和官能团类型异构等。
A . ①②③ B.①②④ C. ②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下的定容密闭容器中,当下列物理量不再随时间变化时,表明反应:
A (s)+2B (g)  C (g)+D (g)一定已达到平衡状态的是:
C (g)+D (g)一定已达到平衡状态的是:
A.混合气体的压强 B.混合气体的密度
C.混合气体的物质的量 D.混合气体中C和D的物质的量比
查看答案和解析>>
科目:高中化学 来源: 题型:
有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
|
| 图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅-硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图II所示电池放电过程中,硫酸浓度不断增大
C.图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图IV所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.已知25℃时部分弱电解质的电离平衡常数数据如下表
| 化学式 | 电离常数(25 ℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | Ka1=4.3×10-7、K a2=5.6×10-11 |
| H2SO3 | Ka1=1.0×10-2、K a2=1.02×10-7 |
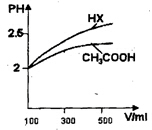 (1)25 ℃时,物质的量浓度均为0.1mol•L-1的四种溶液:a.NaCN溶液 b.Na2CO3溶液c.CH3COONa溶液 d.NaHCO3溶液 , pH由大到小的顺序为________________________。(用字母表示)。
(1)25 ℃时,物质的量浓度均为0.1mol•L-1的四种溶液:a.NaCN溶液 b.Na2CO3溶液c.CH3COONa溶液 d.NaHCO3溶液 , pH由大到小的顺序为________________________。(用字母表示)。
(2)向NaCN溶液中通入少量的CO2,发生反应的离子方程式为_________________ _
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如上图所示,则HX的电离平衡常数_______(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
 (4)25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中 将_ ___ (填“增大”、“减小”或“不变”)
(4)25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中 将_ ___ (填“增大”、“减小”或“不变”)
Ⅱ(5)过氧化尿素(CO(NH2)2·H2O2)是一种新型漂白、消毒剂,其活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品2.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL 6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液不与尿素反应),至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液6.000mL:
 完成并配平下列化学方程式:
完成并配平下列化学方程式:
MnO4— + H2O2 + H+ = Mn2+ + H2O +
② KMnO4溶液应盛放在 滴定管中,若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 (填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量 (填“合格”或“不合格”),活性氧的质量分为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
A.①②③ B.②①③ C.③②① D.③①②
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。

完成下列填空:
(1)氯碱工业主要以食盐为原料。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列操作,正确的操作顺序是 。
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸 ④加过量的Na2CO3溶液
⑤加过量的BaCl2溶液
a.②⑤④①③ b.①④②⑤③ c.④②⑤③① d.⑤②④①③
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是________________,所用主要仪器的名称是____________________。
(3)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是 。
(4)步骤II反应的离子方程式__________________________________________。
(5)Mg(OH)2沉淀中混有Ca(OH)2,可选用__________溶液进行洗涤除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
金刚石和石墨是碳元素的两种结构不同的单质(同素异形体)。在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能。据此,试判断在100kPa压强下,下列结论正确的是
A.石墨比金刚石稳定
B.金刚石比石墨稳定
C.1mol石墨比1mol金刚石的总能量高
D.1mol石墨和1mol金刚石的总能量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com