
【题目】既能使石蕊试液变红,又能使品红试液变为无色的物质是( )
A.NH3 B.HCl C.SO2 D.CO2
科目:高中化学 来源: 题型:
【题目】碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程制得。
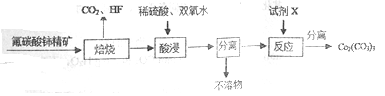
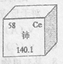
(1)如图是一种稀土元素铈(Ce)在元素周期表中的信息示意图。则铈原子的质子数是______,氟碳酸铈的化学式为CeFCO3,该化合物中,Ce的化合价为_____________;
(2)焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为______________;
(3)试剂X______________;
(4)已知298K时,Ksp[Ce(OH)4]=1×10-29,Ce(OH)4的溶度积表达式为Ksp=______________;为了使溶液中Ce4+沉淀完全,需调节pH为________以上;
(5)取某Ce(OH)4产品1.00g(质量分数为97%),加硫酸溶解后,用0.1000molL-1的FeSO4溶液滴定至终点(铈被还原成Ce3+)则需要滴加标准溶液的体积____________mL,若用硫酸酸化后改用0.1000molL-1
的FeCl2溶液滴定产品从而测定Ce(OH)4产品的质量分数,其它操作都正确,则测定的Ce(OH)4产品的质量分数__________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
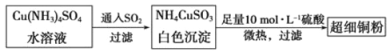
①Cu2+的价电子排布图 ;NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为________(填元素符号)。
②SO42-的空间构型为 ,SO32-离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 。
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,晶体中Cu原子的配位数为 ,晶体的空间利用率为 (列式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
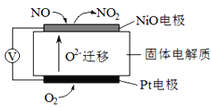
【题目】2015年9月爆发的德国大众车尾气排放作弊事件引起了公众的关注。大众车尾气中常含有大里氮氧化物.通常会采用喷射尿素溶液的方法,将有毒的氮氧化物还原成无污染的物质。大众选择了一种违规做法,即在客户平时用车时不开启喷射尿素的尾气后处理系统,而是通过软件让这一系统只在尾气排放检测时启动。
I、通过NOx传感器可监测空气的NOx的含量,其工作原理图如下图,写出NiO电极的电极反应式__________________;
Ⅱ、以CO2与NH3为原料可合成尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-l59.5kJmol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJmol-1
③H2O(l)=H2O(g) △H=+44.0kJmol-1
(1)写出CO2与NH3合成尿素和液态水的热化学反应方程式____________;
(2)恒温下将2molNH3和1molCO2放入容积为2L的密闭容器中,反应生成NH2CO2NH4(s),2分钟后达到平衡。此时NH3的浓度为0.8mol/L,则CO2的反应速率为________,NH3的转化率是________。
Ⅲ、尿素在一定温度下可分解生成NH3,NH3催化还原NxOy可以消除氮氧化物的污染。已知:
反应a:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l)
5N2(g)+6H2O(l)
反应b:2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
反应c: 4NH3(g)+6NO2(g)![]() 5N2(g)+3O2(g)+6H2O(l)
5N2(g)+3O2(g)+6H2O(l)
(1)相同条件下,反应a在2L密闭容器内,选用不同的催化剂,反应产物N2的量随时间变化如图所示。下列说法正确的是________________。
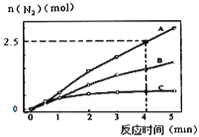
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(2)对于反应c来说,可加快反应速率的措施有_______________(任写2种)
(3)恒温恒容条件下,反应b达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2,在其他条件不变时,再充入NO2气体,NO2体积分数_______(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用自由电子与金属离子的碰撞中有能量传递来解释的物理性质是( )
A.金属是热的良导体
B.金属是电的良导体
C.金属有良好的延展性
D.有金属光泽,不透明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,C及其合金是人类最早使用的金属材料。D与A位于同一主族,是构成地球上矿物质的主要元素。请回答下列问题:
(1)元素A能形成多种单质,其中的一种单质能用作电极、润滑剂与制造铅笔等。A与D所形成的化合物属于 晶体,其中心原子是以 杂化成键;
(2)B的核外电子排布式为 ,
(3)向含有C的硫酸盐中逐滴滴加氨水,所观察到的现象是 ;再向上述溶液中加入乙醇,有 ;原因是 ;
(4)A的氢化物比D的氢化物相比,熔点高是的 (填化学式),理由是
(5)下列说法正确的是( )
a.晶体析出规则是晶格能高的晶体最后析出
b.铜型和钾型都是密置层堆积方式
c.在干冰晶体中,每一个CO2周围有12个紧邻的CO2分子
d.邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点高
(6)下图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为_____________,已知两个最近的Ca原子之间的距离为apm,则该合金的密度为_____________g/cm3,(用含NA和a的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O3)是常用的食品抗氧化剂之一,在空气中被氧化生成的产物为Na2SO4.某小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
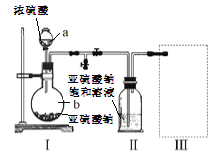
(1)仪器a、b的名称分别是_________、__________。
(2)装置I中产生气体的化学方程式为__________。
(3)要从装置II中获得已析出的晶体,可采用的分离方法是__________,该方法用到的玻璃仪器除烧杯、漏斗还需___________。
(4)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为_________(填序号)。
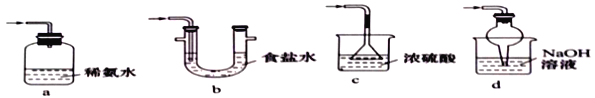
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3
(5)NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是_________(填序号)。
A.测定溶液的pH
B.加入Ba(OH)2溶液
C.加入盐酸
D.加入品红溶液
E.用蓝色石蕊试纸检测
(6)检验Na2S2O5晶体在空气中已被氧化的实验方案是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 I.工业上用洗净的废铜屑作原料来制备硝酸铜。为了节约原料和防止污染环境,宜采取的方法是 (填序号)
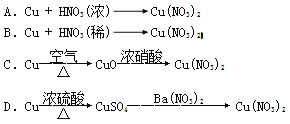
Ⅱ.下图是用过量的铜与40mL稀硝酸在100mL烧瓶中反应制取一氧化氮气体的实验装置图,请回答下列问题:
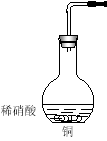

(1)请在右框中画出气体收集装置的装置图。
(2)①从烧瓶中取出少量反应后的溶液,滴入少量氨水,写出该反应的离子方程式: _______________
②反应结束后,能否采取向烧瓶中再加入稀硫酸的方式,再获得一氧化氮气体?如果可以,请写出反应的离子方程式,如果不可以,请说明理由:_________________________________
(3)检查上图装置气密性的操作是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质转化关系如图所示,气体B为红棕色,C常温时为无色液体,相对分子质量D比B大17,E的原子序数为12。
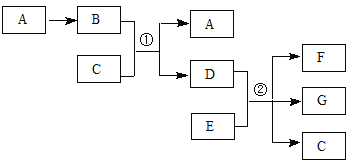
回答下列问题:
(1)A的化学式是 ,C分子的电子式是 。
(2)反应①的离子方程式是 ;若n(E)∶n(D)=2∶5,反应②的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com