
| A. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| B. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| C. | 中和等体积等物质的量浓度的盐酸和醋酸,所消耗的氢氧化钠的物质的量相同 | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
分析 A、KW受温度的影响;
B、NaHCO3溶液与NaAlO2溶液混合产生白色沉淀氢氧化铝;
C、等体积等物质的量浓度的盐酸和醋酸的物质的量相等;
D、CH3COONH4是弱酸弱碱盐,在溶液中会水解,对水的电离有促进作用.
解答 解:A、KW只受温度的影响,在蒸馏水中加入浓硫酸,由于浓硫酸稀释放热,故温度升高,则Kw变大,故A错误;
B、NaHCO3溶液与NaAlO2溶液混合产生白色沉淀氢氧化铝:HCO3-+AlO2-+H2O=A(OH)3↓+CO32-,无气体放出,故B错误;
C、等体积等物质的量浓度的盐酸和醋酸的物质的量相等,故消耗的氢氧化钠的物质的量相等,故C正确;
D、NaCl是强酸强碱盐,在溶液中不水解,对水的电离无影响;CH3COONH4是弱酸弱碱盐,在溶液中会水解,对水的电离有促进作用,两溶液中水的电离程度不相同,故D错误.
故选C.
点评 本题考查了盐类的水解、水的离子积的数值受温度影响等问题,难度不大,应注意的是NaHCO3溶液与NaAlO2溶液混合产生白色沉淀氢氧化铝的反应的书写.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 和
和 E、CH3CH2CH2CH3和
E、CH3CH2CH2CH3和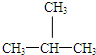
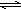 HCO3-+OH-
HCO3-+OH- 的系统命名为:3-甲基-4-乙基-庚烷
的系统命名为:3-甲基-4-乙基-庚烷 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验:
甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com