
【题目】常温下,含碳微粒![]() 、
、![]() 、
、![]() 存在于
存在于![]() 草酸溶液与等浓度NaOH溶液反应后的溶液中,它们的物质的量分数
草酸溶液与等浓度NaOH溶液反应后的溶液中,它们的物质的量分数![]() 某微粒物质的量浓度与三种微粒物质的量浓度和比值
某微粒物质的量浓度与三种微粒物质的量浓度和比值![]() 与溶液pH的关系如图所示,下列有关说法错误的是
与溶液pH的关系如图所示,下列有关说法错误的是![]()
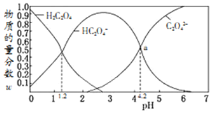
A.向![]() 的溶液中加NaOH溶液将pH增大至
的溶液中加NaOH溶液将pH增大至![]() 的过程中水的电离度一直增大
的过程中水的电离度一直增大
B.![]() 时,溶液中c
时,溶液中c![]()
![]()
![]()
C.![]() 若草酸的第二级电离平衡常数为
若草酸的第二级电离平衡常数为![]() ,则
,则![]()
D.将![]() 相同物质的量浓度
相同物质的量浓度![]() 和
和![]() 的两份溶液等体积混合,可配得图a点所示混合液
的两份溶液等体积混合,可配得图a点所示混合液
科目:高中化学 来源: 题型:
【题目】工业上制备高纯硅有多种方法,其中的一种工艺流程如下:
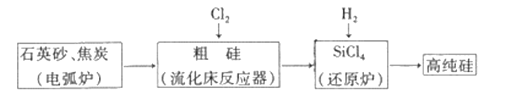
已知:流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是
A. 电弧炉中发生的反应为C+SiO2![]() CO2↑+Si
CO2↑+Si
B. SiCl4进入还原炉之前需要经过蒸馏提纯
C. 每生产l mol高纯硅,需要44. 8L Cl2(标准状况)
D. 该工艺Si的产率高,符合绿色化学要求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】那可汀是—种药物,该药适用于剌激性干咳病人服用,无成瘾性。化合物I是制备该药物的重要中间体,合成路线如下:
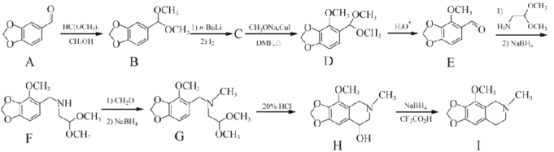
(1)化合物A中的官能团名称为____________(写两种)。
(2)I的分子式为____________。
(3)设计反应A-B的目的为____________。
(4)化合物C的分子式为C10H11O4I,写出C的结构简式:____________。
(5)化合物I的—种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____________。
①分子中含有硝基(—NO2)且直接连在苯环上;②分子中只有3种不同化学环境的氢。
(6)写出以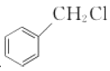 和
和 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() ,向20mL
,向20mL![]() 的
的![]() 溶液中滴加
溶液中滴加![]() 的NaOH溶液
的NaOH溶液![]() 滴定过程中溶液温度保持不变
滴定过程中溶液温度保持不变![]() ,滴定曲线如图1,含磷物种浓度所占分数
,滴定曲线如图1,含磷物种浓度所占分数![]() 随pH变化关系如图2,则下列说法不正确的是
随pH变化关系如图2,则下列说法不正确的是![]()
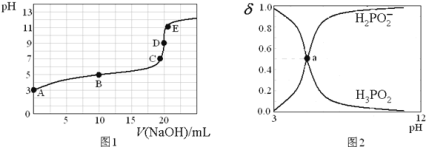
A.![]() 的电离方程式为:
的电离方程式为:![]() ;电离常数
;电离常数![]()
B.B点溶液中存在关系:![]()
C.图2中的a点对应为图1中的B点
D.D点时,溶液中微粒浓度大小关系为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Fe、Fe2O3和CuO的混合粉末加入到100mL 4.4mol/L 的盐酸中,充分反应后,充分反应后,生成标准状况下的氢气896mL。过滤,滤渣经洗涤、干燥后称量,质量为1.28g。滤液中的溶质只有FeCl2和HCl,滤液加水稀释到320mL时,盐酸的浓度为0.25mol/L。
请回答:
(1)反应生成氢气的物质的量为_______ mol;
(2)计算原混合物中铁单质的质量(写出计算过程)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量的PbS等)制备钼酸钠晶体的主要流程如图所示:

(1)Na2MoO4·2H2O中钼元素的化合价是___________。结晶得到的是钼酸钠晶体的粗产品,要得到纯净的钼酸钠晶体,还需要进行的操作是___________(填名称)。
(2)焙烧过程中钼精矿发生的主要化学反应方程式为MoS2+O2-MoO3+SO2(未配平),该反应中氧化产物是___________。
(3)写出“碱浸”反应的离子方程式:_____。为了能提高该反应速率,可采取的措施有_____。
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率是____________%[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略。]
(5)如图是碳钢在盐酸、硫酸和钼酸钠-月桂酰肌氨酸缓释剂3种不同介质中腐蚀速率的实验结果:

①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是___________。
②空气中缓释剂对碳钢的缓蚀原理是在钢铁表面形成 FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀除需加入缓释剂外还需加入NaNO2,NaNO2的作用是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液中的酸碱度, 。
。![]() 时
时 用
用![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 的
的![]() 溶液,AG与所加NaOH溶液的体积
溶液,AG与所加NaOH溶液的体积![]() 的关系如图所示,下列说法不正确的是
的关系如图所示,下列说法不正确的是![]()

A.随着NaOH溶液的加入, 增大
增大
B.![]() 时,
时,![]() 的电离常数
的电离常数![]()
C.b点溶液中存在![]()
D.a、b、c、d、e五点的溶液中,水的电离程度最大的点是d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaH2PO2(次磷酸钠)易溶于水,水溶液近中性,具有强还原性,可用于化学镀银、镍、铬等。一种利用泥磷(含P4和少量CaO、Fe2O3、Al2O3、CaCl2等)为原料制备NaH2PO2·H2O的工艺流程如下:

已知P4与两种碱的反应主要有:
Ⅰ. 2Ca(OH)2+P4+4H2O=2Ca(H2PO2)2+2H2↑ Ⅱ. 4NaOH + P4+8H2O = 4NaH2PO2·H2O+2H2↑
Ⅲ. 4NaOH + P4+2H2O = 2Na2HPO3 +2PH3↑ Ⅳ. NaH2PO2+NaOH = Na2HPO3+H2↑
(1) 已知H3PO2是一元中强酸,NaH2PO2是___________(填“正盐”或“酸式盐”)。
(2)尾气中的PH3被NaClO溶液吸收可生成NaH2PO2,从吸收液中获得NaH2PO2·H2O的操作为______________、______________过滤、洗涤和干燥。
(3) 用NiCl2、NaH2PO2溶液化学镀Ni,同时生成H3PO4和氯化物的化学方程式为:______________________。
(4) “反应”在温度和水量一定时,混合碱总物质的量与P4的物质的量之比[n(碱)/ n(磷)]与NaH2PO2产率的关系如图所示。当n(碱)/ n(磷)>2.6时,NaH2PO2的产率随n(碱)/ n(磷)的增大而降低的可能原因是______。

(5) 滤渣2主要成分为___________________ (填化学式)。
(6) “过滤2”的滤液须用Ag2SO4、Ba(OH) 2及Na2S溶液除去其中Cl-及Fe2+等,其中加入的Ag2SO4溶液不宜过量太多,其主要原因是_________________。
(7)在工业上,可以用惰性电极电解NaH2PO2溶液制取磷酸,请写出其阳极反应式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用少量的溴和足量的乙醇制备1,![]() 二溴乙烷的装置如图所示:
二溴乙烷的装置如图所示:
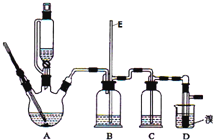
提示:乙醇与浓硫酸在![]() 时脱水生成乙醚,在
时脱水生成乙醚,在![]() 时脱水生成乙烯.有关数据列表如下:
时脱水生成乙烯.有关数据列表如下:
乙醇 | 1, | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度 | 0.79 | 2.2 | 0.71 |
沸点 | 78.5 | 132 | 34.6 |
熔点 | -130 | 9 | -116 |
回答下列问题:
![]() 装置D中发生主要反应的化学方程式为 ______
装置D中发生主要反应的化学方程式为 ______
![]() 装置B的作用 ______ ,长玻璃管E的作用 ______
装置B的作用 ______ ,长玻璃管E的作用 ______
![]() 在装置C中应加入 ______ ,其目的是吸收反应中可能生成的酸性气体
在装置C中应加入 ______ ,其目的是吸收反应中可能生成的酸性气体![]() 填正确选项前的字母
填正确选项前的字母![]()
![]() 水
水![]() 浓硫酸
浓硫酸![]() 氢氧化钠溶液
氢氧化钠溶液![]() 饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
![]() 反应过程中应用冷水冷却装置D,其主要目的是 ______ ;但又不能过度冷却
反应过程中应用冷水冷却装置D,其主要目的是 ______ ;但又不能过度冷却![]() 如用冰水
如用冰水![]() ,其原因是 ______ ;将1,
,其原因是 ______ ;将1,![]() 二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 ______ 层
二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 ______ 层![]() 填“上”、“下”
填“上”、“下”![]()
![]() 若产物中有少量未反应的
若产物中有少量未反应的![]() ,最好用 ______ 洗涤除去
,最好用 ______ 洗涤除去![]() 填正确选项前的字母
填正确选项前的字母![]()
![]() 水
水![]() 氢氧化钠溶液
氢氧化钠溶液![]() 碘化钠溶液
碘化钠溶液![]() 乙醇
乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com