
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
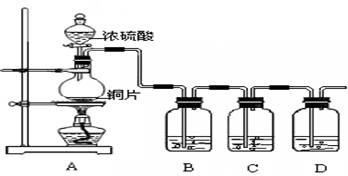
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红 |
| B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红 |
| C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成 |
| D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成 |
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
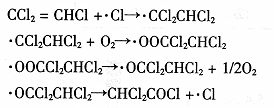
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③⑤⑥ | B.②④⑥⑦ | C.②⑤⑦ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com