
ΓΨΧβΡΩΓΩ“―÷ΣΡ≥Έ¬Ε» ±CH3COOHΒΡΒγάκΤΫΚβ≥Θ ΐΈΣKΓΘΗΟΈ¬Ε»œ¬œρ20 mL 0.1 mol/L CH3COOH»ή“Κ÷–÷πΒΈΦ”»κ0.1 mol/L NaOH»ή“ΚΘ§ΤδpH±δΜ·«ζœΏ»γΆΦΥυ Ψ(Κω¬‘Έ¬Ε»±δΜ·)ΓΘ

œ¬Ν–ΥΒΖ®÷–’ΐ»ΖΒΡ «
A.aΒψ±μ Ψ»ή“Κ÷–c(CH3COOΘ≠)‘ΦΈΣ10-3mol/L
B.bΒψ±μ ΨΒΡ»ή“Κ÷–c(NaΘΪ)ΘΨc(CH3COOΘ≠)
C.cΒψ±μ ΨCH3COOHΚΆNaOH«ΓΚΟΖ¥”ΠΆξ»Ϊ
D.dΒψ±μ ΨΒΡ»ή“Κ÷– ¥σ”ΎK
¥σ”ΎK
ΓΨ¥πΑΗΓΩA
ΓΨΫβΈωΓΩ
AΘ°aΒψcΘ®H+Θ©=10-3mol/LΘ§”…”Ύ¥ΉΥαΈΣ»θΥαΘ§ΥαΡή“÷÷ΤΥ°ΒΡΒγάκΘ§¥ΉΥαΒΡΒγάκ‘Ε‘Ε¥σ”ΎΥ°ΒΡΒγάκΘ§Υυ“‘»ή“Κ÷–«βάκΉ”≈®Ε»ΫϋΥΤΒ»”Ύ¥ΉΥαΗυάκΉ”≈®Ε»Θ§Φ¥cΘ®CH3COO-Θ©‘ΦΈΣ10-3mol/LΘ§Ι A’ΐ»ΖΘΜ
BΘ°»ή“Κ÷–“ΜΕ®¬ζΉψΒγΚ… ΊΚψΘΚcΘ®Na+Θ©+cΘ®H+Θ©=cΘ®OH-Θ©+cΘ®CH3COO-Θ©Θ§bΒψ ±Θ§»ή“Κœ‘ ΨΥα–‘Θ§cΘ®H+Θ©ΘΨcΘ®OH-Θ©Θ§‘ρ”–cΘ®CH3COO-Θ©ΘΨcΘ®Na+Θ©Θ§Ι B¥μΈσΘΜ
CΘ°¥ΉΥαΚΆ«β―θΜ·ΡΤΖ¥”Π…ζ≥…¥ΉΥαΡΤΘ§¥ΉΥαΡΤ ««ΩΦν»θΥα―ΈΤδΥ°»ή“Κ≥ Φν–‘Θ§Β±ΥαΦν«ΓΚΟΖ¥”Π ±»ή“Κ”ΠΗΟ≥ Φν–‘Θ§ΒΪcΒψ»ή“Κ≥ ÷––‘Θ§ΥΒΟςΥαΙΐΝΩΘ§Ι C¥μΈσΘΜ
DΘ°dΒψ ±»ή“ΚΒΡΈ¬Ε»ΟΜ”–±δΜ·Θ§Υυ“‘dΒψ±μ ΨΒΡ»ή“Κ÷– =KΘ§Ι D¥μΈσΘΜ
=KΘ§Ι D¥μΈσΘΜ
Ι ―ΓAΓΘ


 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΧζΓΔΡχΦΑΤδΜ·ΚœΈο‘ΎΙΛ“Β…œ”–ΙψΖΚΒΡ”Π”ΟΓΘ¥”Ρ≥Ωσ‘ϋ ![]() ≥…Ζ÷ΈΣ
≥…Ζ÷ΈΣ![]() ΧζΥαΡχ
ΧζΥαΡχ![]() ΓΔNiOΓΔFeOΓΔCaOΓΔ
ΓΔNiOΓΔFeOΓΔCaOΓΔ![]() Β»
Β»![]() ÷–ΜΊ ’
÷–ΜΊ ’![]() ΒΡΙΛ“’Νς≥Χ»γœ¬ΘΚ
ΒΡΙΛ“’Νς≥Χ»γœ¬ΘΚ
“―÷Σ![]() ‘Ύ
‘Ύ![]() Ζ÷Ϋβ…ζ≥…
Ζ÷Ϋβ…ζ≥…![]() ΚΆ
ΚΆ![]() Θ§ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ§ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
![]() ΓΑΫΰ‘ϋΓ±ΒΡ≥…Ζ÷”–
ΓΑΫΰ‘ϋΓ±ΒΡ≥…Ζ÷”–![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]() ΆβΘ§ΜΙΚ§”–_________
ΆβΘ§ΜΙΚ§”–_________![]() –¥Μ·―ß Ϋ
–¥Μ·―ß Ϋ![]() ΓΘ
ΓΘ
![]() Ωσ‘ϋ÷–≤ΩΖ÷FeO±Κ…’ ±”κ
Ωσ‘ϋ÷–≤ΩΖ÷FeO±Κ…’ ±”κ![]() Ζ¥”Π…ζ≥…
Ζ¥”Π…ζ≥…![]() ΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_____________ΓΘ
ΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_____________ΓΘ
![]() »ήΦΝίΆ»ΓΩ…”Ο”ΎΕ‘»ή“Κ÷–ΒΡΫπ τάκΉ”Ϋχ––ΗΜΦ·”κΖ÷άκΘΚ
»ήΦΝίΆ»ΓΩ…”Ο”ΎΕ‘»ή“Κ÷–ΒΡΫπ τάκΉ”Ϋχ––ΗΜΦ·”κΖ÷άκΘΚ![]() Υ°œύ
Υ°œύ![]() ”–Μζœύ
”–Μζœύ![]() ”–Μζœύ
”–Μζœύ![]() Υ°œύ
Υ°œύ![]() ΓΘίΆ»ΓΦΝ”κ»ή“ΚΒΡΧεΜΐ±»
ΓΘίΆ»ΓΦΝ”κ»ή“ΚΒΡΧεΜΐ±»![]() Ε‘»ή“Κ÷–
Ε‘»ή“Κ÷–![]() ΓΔ
ΓΔ![]() ΒΡίΆ»Γ¬ ”Αœλ»γœ¬ΆΦΥυ ΨΘ§
ΒΡίΆ»Γ¬ ”Αœλ»γœ¬ΆΦΥυ ΨΘ§![]() ΒΡΉνΦ―»Γ÷ΒΈΣ________ΓΘ‘Ύ_______
ΒΡΉνΦ―»Γ÷ΒΈΣ________ΓΘ‘Ύ_______![]() ΧνΓΑ«ΩΦν–‘Γ±ΓΑ«ΩΥα–‘Γ±ΜρΓΑ÷––‘Γ±
ΧνΓΑ«ΩΦν–‘Γ±ΓΑ«ΩΥα–‘Γ±ΜρΓΑ÷––‘Γ±![]() Ϋι÷ ÷–ΓΑΖ¥ίΆ»ΓΓ±Ρή Ι”–Μζœύ‘Ό…ζΕχ―≠ΜΖάϊ”ΟΓΘ
Ϋι÷ ÷–ΓΑΖ¥ίΆ»ΓΓ±Ρή Ι”–Μζœύ‘Ό…ζΕχ―≠ΜΖάϊ”ΟΓΘ
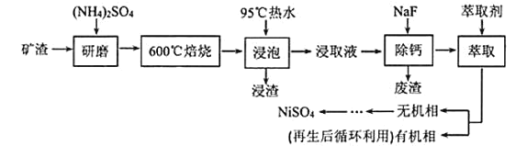
![]() “‘FeΓΔNiΈΣΒγΦΪ÷Τ»Γ
“‘FeΓΔNiΈΣΒγΦΪ÷Τ»Γ![]() ΒΡ‘≠άμ»γœ¬ΆΦΥυ ΨΓΘΆ®ΒγΚσΘ§‘ΎΧζΒγΦΪΗΫΫϋ…ζ≥…ΉœΚλ…ΪΒΡ
ΒΡ‘≠άμ»γœ¬ΆΦΥυ ΨΓΘΆ®ΒγΚσΘ§‘ΎΧζΒγΦΪΗΫΫϋ…ζ≥…ΉœΚλ…ΪΒΡ![]() Θ§»τpHΙΐΗΏΘ§ΧζΒγΦΪ«χΜα≤ζ…ζΚλΚ÷…ΪΈο÷ ΓΘ
Θ§»τpHΙΐΗΏΘ§ΧζΒγΦΪ«χΜα≤ζ…ζΚλΚ÷…ΪΈο÷ ΓΘ
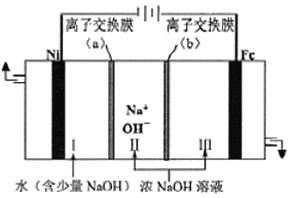
![]() ΒγΫβ ±―τΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣ_________Θ§άκΉ”ΫΜΜΜΡΛ
ΒγΫβ ±―τΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣ_________Θ§άκΉ”ΫΜΜΜΡΛ![]() ΈΣ________
ΈΣ________![]() ΧνΓΑ“θΓ±ΜρΓΑ―τ
ΧνΓΑ“θΓ±ΜρΓΑ―τ![]() άκΉ”ΫΜΜΜΡΛΓΘ
άκΉ”ΫΜΜΜΡΛΓΘ
![]() œρΧζΒγΦΪ«χ≥ωœ÷ΒΡΚλΚ÷…ΪΈο÷ ÷–Φ”»κ…ΌΝΩΒΡNaClO»ή“ΚΘ§≥ΝΒμ»ήΫβΓΘΗΟΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ__________ΓΘ
œρΧζΒγΦΪ«χ≥ωœ÷ΒΡΚλΚ÷…ΪΈο÷ ÷–Φ”»κ…ΌΝΩΒΡNaClO»ή“ΚΘ§≥ΝΒμ»ήΫβΓΘΗΟΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ__________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Ύœ¬Ν–ΗχΕ®ΧθΦΰΒΡ»ή“Κ÷–Θ§“ΜΕ®Ρή¥σΝΩΙ≤¥φΒΡάκΉ”Ήι «( )
AΘ°Έό…Ϊ»ή“ΚΘΚCa2+ΓΔH+ΓΔCl-ΓΔHSO3-
BΘ°Ρή ΙpH ‘÷Ϋ≥ Κλ…ΪΒΡ»ή“ΚΘΚNa+ΓΔNO3-ΓΔI-ΓΔAlO2-
CΘ°FeCl3»ή“ΚΘΚK+ΓΔNa+ΓΔFe2+ΓΔS2-
DΘ°![]() =0.1 molL-1ΒΡ»ή“ΚΘΚNa+ΓΔK+ΓΔSiO32-ΓΔNO3-
=0.1 molL-1ΒΡ»ή“ΚΘΚNa+ΓΔK+ΓΔSiO32-ΓΔNO3-
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈ“ΙζΨΏ”–ΙβΜ‘≤”άΟΒΡΙ≈¥ζΩΤΦΦΘ§‘γ‘Ύ…Χ¥ζΨΆ“―Ψ≠÷ΐ‘λ≥ωΥΨΡΗΈλ¥σΖΫΕΠΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©Cu‘Ύ‘ΣΥΊ÷ήΤΎ±μ÷–ΒΡΈΜ÷Ο___Θ§Cu2+ΒΡΦέΒγΉ”≈≈≤Φ ΫΈΣ__ΓΘ
Θ®2Θ©“―÷ΣΜυΧ§Ά≠ΒΡ≤ΩΖ÷ΒγάκΡή»γ±μΥυ ΨΘΚ
ΒγάκΡή/kJΓΛmolΘ≠1 | I1 | I2 | I3 |
Cu | 746 | 1958 | 2058 |
”…±μΗώ ΐΨί÷ΣΘ§I2(Cu)‘Ε‘Ε¥σ”ΎI1(Cu)Θ§Τδ‘≠“ρ «__ΓΘ
Θ®3Θ©Cu2+Ρή”κΏΝΩ©(![]() )ΒΡ“θάκΉ”(
)ΒΡ“θάκΉ”(![]() )–Έ≥…ΥΪΏΝΩ©Ά≠ΓΘ
)–Έ≥…ΥΪΏΝΩ©Ά≠ΓΘ
ΔΌ![]() ÷–CΚΆN‘≠Ή”ΒΡ‘”Μ·ΨυΈΣ__Θ§1mol
÷–CΚΆN‘≠Ή”ΒΡ‘”Μ·ΨυΈΣ__Θ§1mol![]() Κ§”–__molΠ“ΦϋΘΜ
Κ§”–__molΠ“ΦϋΘΜ
ΔΎΥΪΏΝΩ©Ά≠Cu(![]() )2ΒΡ≈δΈΜ‘≠Ή”ΈΣ__ΘΜ
)2ΒΡ≈δΈΜ‘≠Ή”ΈΣ__ΘΜ![]() ύγΖ‘ΒΡΖ–ΒψΈΣ84ΓφΘ§ΏΝΩ©(
ύγΖ‘ΒΡΖ–ΒψΈΣ84ΓφΘ§ΏΝΩ©(![]() )ΒΡΖ–Βψ‘Ύ129~131Γφ÷°ΦδΘ§ΏΝΩ©Ζ–ΒψΫœΗΏΘ§Τδ‘≠“ρ «__ΓΘ
)ΒΡΖ–Βψ‘Ύ129~131Γφ÷°ΦδΘ§ΏΝΩ©Ζ–ΒψΫœΗΏΘ§Τδ‘≠“ρ «__ΓΘ
Θ®4Θ©Ρ≥M‘≠Ή”ΒΡΆβΈßΒγΉ”≈≈≤Φ ΫΈΣ3s23p5Θ§Ά≠”κM–Έ≥…Μ·ΚœΈοΒΡΨßΑϊ»γΆΦΥυ Ψ(ΑΉ«ρ¥ζ±μM‘≠Ή”)ΓΘΟΩΗωΆ≠‘≠Ή”÷ήΈßΨύάκΉνΫϋΒΡΆ≠‘≠Ή” ΐΡΩ__ΘΜΗΟΨßΧεΒΡΜ·―ß ΫΈΣ__ΓΘ“―÷ΣΗΟΨßΧεΒΡΟήΕ»ΈΣΠ―gΓΛcmΘ≠3Θ§ΨßΧεΒΡΡΠΕϊ÷ ΝΩΈΣMg/molΘ§ΑΔΖϋΌΛΒ¬¬ό≥Θ ΐΒΡ÷ΒΈΣNAΘ§‘ρΗΟΨßΧε÷–Ά≠‘≠Ή”ΚΆM‘≠Ή”÷°ΦδΒΡΉνΕΧΨύάκΈΣ__pm(÷Μ–¥ΦΤΥψ Ϋ)ΓΘ
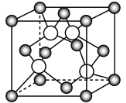
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ “Έ¬œ¬Θ§pH ΨυΈΣ2ΒΡΝΫ÷÷“Μ‘ΣΥαHAΚΆHBΗς1mL,Ζ÷±πΦ”Υ°œΓ Ά,pH Υφ»ή“ΚΧεΜΐΒΡ±δΜ·«ζœΏ»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
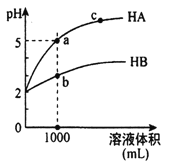
A. HAΒΡΥα–‘±»HBΒΡΥα–‘»θ
B. aΒψ»ή“ΚΒΡΒΦΒγ–‘±»cΒψ»ή“ΚΒΡΒΦΒγ–‘»θ
C. »τΝΫ»ή“ΚΦ”Υ°œΓ ΆΘ§‘ρΥυ”–άκΉ”ΒΡ≈®Ε»ΕΦΦθ–Γ
D. Ε‘aΓΔbΝΫΒψ»ή“ΚΆ§ ±…ΐΗΏΈ¬Ε»Θ§‘ρc(A-)/c(B-)Φθ–Γ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷Σ”–ΜζΈοΘΚ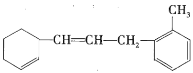 ΓΘ
ΓΘ
Θ®1Θ©ΗΟΈο÷ ±ΫΜΖ…œΒΡ“Μ¬»¥ζΈο”–________÷÷ΓΘ
Θ®2Θ©![]() ΗΟΈο÷ ΚΆΉψΝΩδεΥ°ΜλΚœΘ§œϊΚΡ
ΗΟΈο÷ ΚΆΉψΝΩδεΥ°ΜλΚœΘ§œϊΚΡ![]() ΒΡΈο÷ ΒΡΝΩΈΣ________
ΒΡΈο÷ ΒΡΝΩΈΣ________![]() ΓΘ
ΓΘ
Θ®3Θ©![]() ΗΟΈο÷ ΚΆ
ΗΟΈο÷ ΚΆ![]() Φ”≥…ΉνΕύœϊΚΡ
Φ”≥…ΉνΕύœϊΚΡ![]() ________
________![]() ΓΘ
ΓΘ
Θ®4Θ©œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «________Θ®Χν–ρΚ≈Θ©ΓΘ
a.ΗΟ”–ΜζΈοΩ…ΖΔ…ζΦ”≥…ΓΔ»Γ¥ζΓΔ―θΜ·Β»Ζ¥”Π
b.ΗΟ”–ΜζΈοΚΆΦΉ±Ϋ τ”ΎΆ§œΒΈο
c.ΗΟ”–ΜζΈο ΙδεΥ°Ά …ΪΒΡ‘≠άμ”κ““œ©œύΆ§
d.ΗΟ”–ΜζΈοΡή ΙΥα–‘![]() »ή“ΚΆ …ΪΘ§ΖΔ…ζΒΡ «Φ”≥…Ζ¥”Π
»ή“ΚΆ …ΪΘ§ΖΔ…ζΒΡ «Φ”≥…Ζ¥”Π
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΑΔΖϋΦ”Β¬¬ό≥Θ ΐΒΡ÷ΒΈΣNAΘ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. ±ξΉΦΉ¥Ωωœ¬Θ§2.24LCH3OHΖ÷Ή”÷–Ι≤ΦέΦϋΒΡ ΐΡΩΈΣ0.5NA
B. 1molNa2O2”κΉψΝΩCO2≥δΖ÷Ζ¥”ΠΘ§ΉΣ“ΤΒΡΒγΉ” ΐΈΣ2 NA
C. 25Γφ1LpH=12ΒΡNa2CO3»ή“Κ÷–Θ§”…Υ°Βγάκ≥ωH+ΒΡ ΐΡΩΈΣ0.01NA
D. 0.1molH2ΚΆ0.1molI2”ΎΟή±’»ίΤς÷–≥δΖ÷Ζ¥”ΠΚσΘ§HIΖ÷Ή”Ήή ΐΈΣ0.2NA
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ÷ΟΜΜΖ¥”ΠΩ…“‘”Ο»γΆΦ±μ ΨΘ§œ¬Ν–”–ΙΊ÷ΟΜΜΖ¥”ΠΒΡΥΒΖ®¥μΈσΒΡ «

A.»τ““ «“Μ÷÷≥ΘΦϊΑκΒΦΧε≤ΡΝœΘ§ΙΛ“Β…œάϊ”Ο…œ ωΖ¥”Π÷Τ»Γ““ΒΡΜ·―ßΖΫ≥Χ ΫΈΣ
![]()
B.»τΦΉ «¬ΝΘ§±ϊ «![]() Θ§ΙΐΝΩΒΡΦΉ”κ±ϊΖ¥”ΠΚσΘ§Ω…Φ”»κΉψΝΩΒΡNaOH»ή“Κ≥δΖ÷Ζ¥”ΠΚσΘ§Ιΐ¬ΥΘ§ΫΪ≤ζΈο““Ζ÷άκ≥ωά¥
Θ§ΙΐΝΩΒΡΦΉ”κ±ϊΖ¥”ΠΚσΘ§Ω…Φ”»κΉψΝΩΒΡNaOH»ή“Κ≥δΖ÷Ζ¥”ΠΚσΘ§Ιΐ¬ΥΘ§ΫΪ≤ζΈο““Ζ÷άκ≥ωά¥
C. ![]() ΚΆ
ΚΆ![]() Ω…ΖΔ…ζ÷ΟΜΜΖ¥”ΠΘ§ΫΪΒ»Έο÷ ΒΡΝΩΒΡ
Ω…ΖΔ…ζ÷ΟΜΜΖ¥”ΠΘ§ΫΪΒ»Έο÷ ΒΡΝΩΒΡ![]() ΓΔ
ΓΔ![]() ΜλΚœΘ§≥δΖ÷Ζ¥”ΠΘ§±Μ―θΜ·ΒΡB‘ΣΥΊ”κΈ¥±Μ―θΜ·ΒΡB‘ΣΥΊ÷ ΝΩ÷°±» «1ΓΟ1
ΜλΚœΘ§≥δΖ÷Ζ¥”ΠΘ§±Μ―θΜ·ΒΡB‘ΣΥΊ”κΈ¥±Μ―θΜ·ΒΡB‘ΣΥΊ÷ ΝΩ÷°±» «1ΓΟ1
D.»τΦΉ «CuΘ§““ «![]() Θ§…ηΦΤΒγΫβ≥Ί Βœ÷ΗΟ÷ΟΜΜΖ¥”ΠΘ§‘ρΆ≠Τ§ΈΣ―τΦΪ
Θ§…ηΦΤΒγΫβ≥Ί Βœ÷ΗΟ÷ΟΜΜΖ¥”ΠΘ§‘ρΆ≠Τ§ΈΣ―τΦΪ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΈμω≤ΧλΤχΒΡΓΑΉοΩΐΜω ΉΓ± «Ω’Τχ÷–ΒΡCOΓΔNOΓΔNO2Β»Έέ»ΨΤχΧε‘Ύ¥σΤχ÷–Ζ¥”Π≤ζ…ζPM2.5 Ω≈ΝΘΈοΘ§―–ΨΩNOΓΔNO2ΓΔCO Β»Έέ»ΨΈοΒΡ¥ΠάμΘ§Ε‘ΜΖΨ≥±ΘΜΛ”–÷Ί“ΣΒΡ“β“εΓΘ
(1)“―÷ΣΘΚ
NO2(g)+CO(g) = CO2 (g)+NO(g) ΓςH =Θ≠230.0kJΓΛmol-1
N2 (g)+O2 (g) = 2NO(g) ΓςH =Θ≠180.0 kJΓΛmol-1
2NO(g)+O2 (g) = 2NO2 (g) ΓςH =Θ≠112.3kJΓΛmol-1
»τNO2ΤχΧεΚΆCO ΤχΧεΖ¥”Π…ζ≥…ΈόΈέ»ΨΤχΧεΘ§Τδ»»Μ·―ßΖΫ≥Χ ΫΈΣ_____ΓΘ
(2) ”…CO…ζ≥…CO2ΒΡΜ·―ßΖΫ≥Χ ΫΈΣCOΘΪO2![]() CO2ΘΪOΓΘΤδ’ΐΖ¥”ΠΥΌ¬ ΈΣv’ΐ=K’ΐΓΛc(CO) ΓΛc(O2)Θ§ΡφΖ¥”ΠΥΌ¬ ΈΣvΡφ=KΡφΓΛc(CO2) ΓΛc(O)Θ§K’ΐΓΔKΡφΈΣΥΌ¬ ≥Θ ΐΓΘ“―÷ΣΡ≥“ΜΈ¬Ε» ±Θ§ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐK=0.40Θ§K’ΐ=1.24ΓΝ105 LΓΛs-1ΓΛmol-1Θ§¥Υ ±KΡφ=_____LΓΛs-1ΓΛmol-1ΓΘ
CO2ΘΪOΓΘΤδ’ΐΖ¥”ΠΥΌ¬ ΈΣv’ΐ=K’ΐΓΛc(CO) ΓΛc(O2)Θ§ΡφΖ¥”ΠΥΌ¬ ΈΣvΡφ=KΡφΓΛc(CO2) ΓΛc(O)Θ§K’ΐΓΔKΡφΈΣΥΌ¬ ≥Θ ΐΓΘ“―÷ΣΡ≥“ΜΈ¬Ε» ±Θ§ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐK=0.40Θ§K’ΐ=1.24ΓΝ105 LΓΛs-1ΓΛmol-1Θ§¥Υ ±KΡφ=_____LΓΛs-1ΓΛmol-1ΓΘ
(3)Τϊ≥ΒΒΡ≈≈ΤχΙή…œΑ≤ΉΑΓΑ¥ΏΜ·ΉΣΜ·ΤςΓ±Θ§ΤδΖ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣΘΚ2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΓςH<0ΓΘTΓφ ±Θ§ΫΪΒ»Έο÷ ΒΡΝΩΒΡNO ΚΆCO ≥δ»κ»ίΜΐΈΣ2L ΒΡΟή±’»ίΤς÷–Θ§»τΈ¬Ε»ΚΆΧεΜΐ≤Μ±δΘ§Ζ¥”ΠΙΐ≥Χ÷–(0ΓΪ15min) NO ΒΡΈο÷ ΒΡΝΩΥφ ±Φδ±δΜ·»γΆΦΓΘ
2CO2(g)+N2(g) ΓςH<0ΓΘTΓφ ±Θ§ΫΪΒ»Έο÷ ΒΡΝΩΒΡNO ΚΆCO ≥δ»κ»ίΜΐΈΣ2L ΒΡΟή±’»ίΤς÷–Θ§»τΈ¬Ε»ΚΆΧεΜΐ≤Μ±δΘ§Ζ¥”ΠΙΐ≥Χ÷–(0ΓΪ15min) NO ΒΡΈο÷ ΒΡΝΩΥφ ±Φδ±δΜ·»γΆΦΓΘ
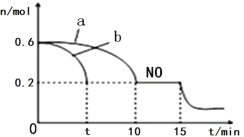
ΔΌΆΦ÷–aΓΔb Ζ÷±π±μ Ψ‘ΎœύΆ§Έ¬Ε»œ¬Θ§ Ι”Ο÷ ΝΩœύΆ§ΒΪ±μΟφΜΐ≤ΜΆ§ΒΡ¥ΏΜ·ΦΝ ±Θ§¥οΒΫΤΫΚβΙΐ≥Χ÷–n (NO)ΒΡ±δΜ·«ζœΏΘ§Τδ÷–±μ Ψ¥ΏΜ·ΦΝ±μΟφΜΐΫœ¥σΒΡ«ζœΏ «________(ΧνΓΑaΓ±ΜρΓΑbΓ±) ΓΘ
ΔΎTΓφ ±Θ§ΗΟΖ¥”ΠΒΡΜ·―ßΤΫΚβ≥Θ ΐK=____ΘΜ(±ΘΝτ–Γ ΐΒψΚσ“ΜΈΜ–Γ ΐ)ΤΫΚβ ±»τ±Θ≥÷Έ¬Ε»≤Μ±δΘ§‘Όœρ»ίΤς÷–≥δ»κCOΓΔCO2Ης0.2 molΘ§‘ρΤΫΚβΫΪ_____“ΤΕ·ΓΘ(ΧνΓΑœρΉσΓ±ΓΔΓΑœρ”“Γ±ΜρΓΑ≤ΜΓ±)
Δέ15min ±Θ§»τΗΡ±δΆβΫγΖ¥”ΠΧθΦΰΘ§ΒΦ÷¬n (NO)ΖΔ…ζΆΦ÷–Υυ Ψ±δΜ·Θ§‘ρΗΡ±δΒΡΧθΦΰΩ…Ρή «_________(»Έ¥π“ΜΧθΦ¥Ω…)ΓΘ
(4)NO2Ω…”ΟΑ±Υ°Έϋ ’…ζ≥…NH4NO3ΓΘ25Γφ ±Θ§ΫΪx mol NH4NO3»ή”ΎΥ°Θ§»ή“Κœ‘Υα–‘Θ§‘≠“ρ «_________”ΟάκΉ”ΖΫ≥Χ Ϋ±μ Ψ)ΓΘœρΗΟ»ή“ΚΒΈΦ”c L Α±Υ°Κσ»ή“Κ≥ ÷––‘Θ§‘ρΥυΒΈΦ”Α±Υ°ΒΡ≈®Ε»ΈΣ_____molL©¹1ΓΘ(NH3H2O ΒΡΒγάκΤΫΚβ≥Θ ΐK =2ΓΝ10©¹5 molL©¹1)
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com