
铁是人类必需的微量元素之一,它可以促进血红蛋白结合氧分子进行输氧,医学上经常用硫酸亚铁糖衣片给患贫血的病人补铁.请根据以下药品说明书回答问题:

(1)药片上的糖衣可以起__________的作用,鉴定时溶解加盐酸的目的是____________。
(2)某研究小组甲欲用KMnO4测定FeSO4的含量。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250毫升,配制时需要的仪器除托盘天平、烧杯、玻璃棒、量筒外,还需要的仪器有__________、___________。
②滴定时含硫酸亚铁的滤液放在___________(填仪器)中,高锰酸钾溶液放在__________(填仪器)中,滴定时加入___________(填“酚酞”或“甲基橙”或“石蕊”或“不用加”)指示剂,如何判断达到滴定终点_____________。
(3)另一研究小组乙设计了如下测量方案:
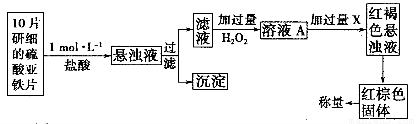
①此检验过程中加过量H2O2反应的离子方程式为______________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有___________(按操作的顺序填写)。
A.过滤????? B.洗涤????? C.萃取???? D.分液???? E.冷却???? F.灼烧
③最后称量红棕色固体的质量为0.8960g,那么该药片中硫酸亚铁的质量分数为_________(小数点后面保留一位有效数字)。
(1)隔绝空气,防止被O2氧化。防止Fe2+水解。
(2)①250ml的容量瓶? 胶头滴管。
②锥形瓶 酸式滴定管 不用加最后一滴酸性高锰酸钾溶液滴入锥形瓶中,溶液变为紫色,振荡,半分钟内不恢复原色,则滴定达到了终点。
(3)①2Fe2++2H++H2O2=2Fe3++2H2O. ? ②A B F E ③ 56.7%.
【解析】
试题分析:(1)FeSO4不稳定,容易被空气中的氧气氧化为Fe2(SO4)3 .为了防止FeSO4被氧化,所以外加了糖衣来起保护作用,以隔绝空气。FeSO4是强碱弱酸盐,Fe2+容易发生水解反应而使溶液变浑浊。加盐酸可以使水解平衡逆向移动,就防止了它的水解的进行所以在溶解鉴定时要加入盐酸。(2)①准确配制一定浓度的一定体积的溶液时,需要的仪器除托盘天平、烧杯、玻璃棒、量筒、250ml的容量瓶、胶头滴管 。②该实验是用已知浓度的酸性高锰酸钾溶液来滴定未知浓度的硫酸亚铁。所以滴定时含硫酸亚铁的滤液放在锥形瓶中,因为酸性高锰酸钾溶液由强的氧化性,溶液腐蚀橡胶管,所以应该盛放在酸式滴定管中。因为高锰酸钾溶液为紫色,当反应消耗后会变为无色的Mn2+。因此不用外加指示剂,通过其本身的颜色变化就可以确定滴定终点。当向锥形瓶中滴加最后一滴酸性高锰酸钾溶液时,溶液由无色变为紫色,振荡,半分钟内不恢复原色,则证明滴定达到了终点。(3)①Fe2+有还原性,H2O2有氧化性,二者在酸性条件下会发生氧化反应反应:2Fe2++2H++H2O2=2Fe3++2H2O.加入过量是为了使所有的Fe2+完全变为Fe3+.②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有过滤、洗涤、灼烧、冷却。因此选项为A B F E。③根据Fe守恒可知2FeSO4——Fe2O3. n(Fe2O3)= m/M=0.8960g ÷160g/mol=0.0056mol,所以n(FeSO4)=0.0112mol. m(FeSO4)=n·M=0.0112mol×152g/mol=1.7024g.所以该药片中硫酸亚铁的质量分数为1.7024g÷(10×0.3)×100%=56.7%.
考点:考查滴定法在物质含量测定中的应用。包括物质的量浓度的溶液的配制、滴定终点的判断、仪器的选择与使用、混合物的分离、离子方程式的书写、盐的水解及影响因素等知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是人类必需的微量元素之一,它可以促进血红蛋白结合氧分子进行输氧,医学上经常用硫酸亚铁糖衣片给患贫血的病人补铁.请根据以下药品说明书回答问题:
硫酸亚铁片
硫酸亚铁片
本品含硫酸亚铁(FeSO4·7H2O)应为标示量的95.0%~110.0%。
【性状】 本品为糖衣片,除去糖衣后显淡蓝绿色。
【鉴别】 取本品,除去糖衣,研细,称取适量(约相当于硫酸亚铁0.2 g),加稀盐酸1滴与水20 mL,振摇使硫酸亚铁溶解,过滤,滤液进行亚铁盐与硫酸盐的鉴别反应。
【规格】 0.3 g
【贮藏】 密封,在干燥处保存。
(1)药片上的糖衣可以起________的作用,鉴定时溶解加盐酸的目的是____________
____________________________________.
(2)某研究小组甲欲用KMnO4测定FeSO4的含量。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250毫升,配制时需要的仪器除托盘天平外,还需要的仪器有________、________、________、________、 ________。
②滴定时含硫酸亚铁的滤液放在________(填仪器)中,高锰酸钾溶液放在_____(填仪器)中,滴定终点时溶液的颜色为________色。
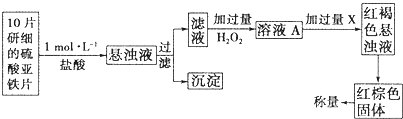
(3)另一研究小组乙设计了如下测量方案:

①过滤时用到的玻璃仪器有______________________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有________(按操作的顺序填写)。
A.过滤 B.洗涤 C.萃取 D.分液 E.冷却 F.灼烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com