
| A. | 盐酸 | B. | 碳酸氢铵 | C. | 二氧化硫 | D. | 氯气 |
分析 能够导电的溶液中存在自由移动的带电荷离子,在水溶液和熔融状态下都不导电的化合物为非电解质,注意单质和混合物既不是电解质,也不是非电解质,据此进行解答.
解答 解:A.盐酸为混合物,不属于电解质和非电解质,故A错误;
B.碳酸氢铵为电解质,不属于非电解质,故B错误;
C.二氧化硫在水溶液中能够导电,由于导电离子不是二氧化硫电离的,则二氧化硫为非电解质,故C正确;
D.氯气为单质,单质既不是电解质,也不是非电解质,故D错误;
故选C.
点评 本题考查了电解质与非电解质、溶液导电性判断,题目难度不大,明确电解质与非电解质的概念为解答关键,注意掌握溶液导电性条件,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:实验题
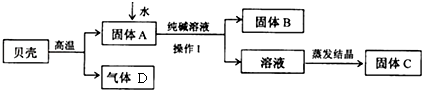
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量稀硫酸 | 无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和碳酸钠溶液 | 出现白色沉淀 | 猜想成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
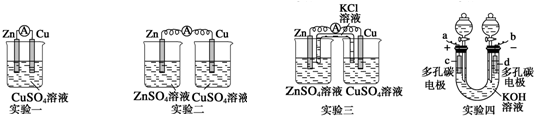
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| A | CCl4 | Br2 | 用NaOH溶液洗涤、分液 |
| B | FeCl3 | CaCO3 | 溶解、过滤、蒸发结晶 |
| C | Al2(SO4)3溶液 | MgSO4 | 加入过量烧碱后过滤,再用硫酸酸化滤液 |
| D | CO2 | SO2 | 通过盛有品红溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol二甲醚中含有的C-O键的数目为2NA | |
| B. | 标准状况下,44.8LHF中含有分子的数目为2NA | |
| C. | 200g质量分数为23%的HCOOH水溶液中含氧原子的总数目为2NA | |
| D. | 在反应Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2中,每生成1molCu,转移电子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
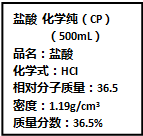 按要求完成下列小题.
按要求完成下列小题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰镇的啤酒打开后泛起泡沫 | |
| B. | 对N2+3H2?2NH3的反应,使用铁触媒可加快合成氨反应的速率 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com