
下列反应属于取代反应的是
A.CH4与Cl2的混合气体光照后颜色变浅 B.乙烯通入酸性KMnO4溶液中,溶液褪色
C.苯与溴水混合后振荡,水层褪色 D.乙烯通入溴水中,溴水褪色
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
常温时,下列叙述正确的是
A. pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c(NH4+)
B. pH=2.5的可乐中c(H+) 是pH=3.5的柠檬水中c(H+)的10倍
C. AgCl在0.1mol /L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同
D. 1 mL 1mol /L Na2CO3溶液加水稀释至100mL, pH和Kw均减小
| |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)标出有机物 中的手性碳原子
中的手性碳原子
(2)写出此有机物分别发生下列反应的化学方程式。
①与H2加成 _____ ______ _______ __
②与乙酸反应_____ ______ _______ __
③与Na反应_____ _______ _______ __
(3)第_____ __反应后,生成的有机物分子不再含有手性碳原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程。
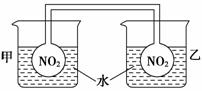
①按图所示将实验装置连接好。
②向甲烧杯的水中投入一定量的CaO固体,此烧杯中的NO2平衡混合气体的红棕色变深;向乙烧杯中加入NH4NO3晶体,此时烧杯中NO2平衡混合气体颜色变浅。
回答下列问题:
(1)CaO与水反应的化学方程式为______________________________,该反应为________(填“吸热反应”或“放热反应”)。
(2)NH4NO3晶体溶于水温度________(填“升高”或“降低”)。NH4NO3溶于水________(填“是”或“不是”)吸热反应。
(3)查阅资料知NO2的平衡气体中存在的可逆反应为2NO2(g) 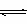 N2O4(g),已知NO2为红棕色,N2O4为无色,结合实验知,当温度升高时,平衡________(填“未被破坏”或“发生移动”),此时反应速率________(填“增大”、“减小”或“不变化”)。混合气体的颜色不变______(填“能”或“不能”)证明反应已达平衡。
N2O4(g),已知NO2为红棕色,N2O4为无色,结合实验知,当温度升高时,平衡________(填“未被破坏”或“发生移动”),此时反应速率________(填“增大”、“减小”或“不变化”)。混合气体的颜色不变______(填“能”或“不能”)证明反应已达平衡。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中不需加热的吸热反应是
A.锌粒与稀硫酸的反应 B.灼热的木炭与CO2反应
C.甲烷在氧气中的燃烧反应 D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组设计了如图所示装置,调节滑动变阻器,在电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b)。由于粗心,实验并未达到预期目的,但也看到了令人高兴的现象。请帮助他们分析并回答下列问题(图中阳离子交换膜只允许阳离子和水分子通过):
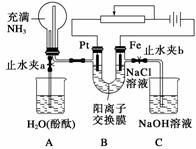
(1)写出B装置中的电极反应式:
Pt极____________________________________________________________________;
Fe极____________________________________________________________________。
(2)写出观察到的A装置中的现象:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(3)当观察到A装置中的现象后,他们关闭止水夹a,打开止水夹b,再观察C装置。若无现象,说明理由;若有现象,请写出有关反应方程式__________________________
________________________________________________________________________。
(4)若想达到电解NaCl溶液的目的,应如何改进装置,请提出你的意见________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。
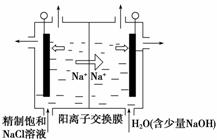
①图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为_____________________________________________________________
________________________________________________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________ mol;用平衡移动原理解释阴极区pH增大的原因:_____________________________________________________________________
________________________________________________________________________。
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为_________________________________________________
________________________________________________________________________。
若以该电池为电源,用石墨作电极电解100 mL含有如下离子的溶液。
| 离子 | Cu2+ | H+ | Cl- | SO |
| c/mol·L-1 | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为________ mol。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将 Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用右 图装置模拟上述过程:
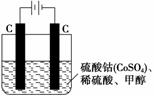
①写出阳极电极反应式:_________________________________________________。
②除去甲醇的离子反应为6Co3++CH3OH+H2O===CO2↑+6Co2++6H+,该过程中被氧化的元素是__________,当产生标准状况下2.24 L CO2时,共转移电子________ mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com