
| A. | 2g | B. | 4g | C. | 8g | D. | 18g |
分析 本题给出的数据不足,故不能求出每一种金属的质量只能确定取值范围,三种金属中产生等量的氢气质量最大的为锌,质量最小的为铝;故假设金属全部为锌可求的金属质量为16.25g,假设金属全部为铝可求的金属质量为4.5g,金属实际质量应在4.5g~16.25g之间,以此解答该题.
解答 解:标准状况下5.6L氢气的物质的量为:n(H2)=$\frac{5.6L}{22.4L/mol}$=0.25mol,三种金属中产生等量的氢气质量最大的为锌,质量最小的为铝;故假设金属全部为锌可求的金属质量为0.25mol×65g/mol=16.25g,假设金属全部为铝可求的金属质量为0.25mol×$\frac{2}{3}$×27g/mol=4.5g,金属实际质量应在4.5g~16.25g之间,故AB不可能,可能的为CD,
故选CD.
点评 本题考查混合物的计算,可用极端假设法解答,极端假设法”是用数学方法解决化学问题的常用方法,一般解答有关混合物计算时采用,可分别假设原混合物是某一纯净物,进行计算,确定最大值、最小值,再进行分析、讨论、得出结论,题目难度不大.


科目:高中化学 来源: 题型:选择题
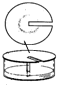 常温下,在丙酮-盐酸混合溶液中,Fe3+比Cu2+的溶解度更大,用该溶液作展开剂分离Fe3+和Cu2+的装置如图.以下叙述错误的是( )
常温下,在丙酮-盐酸混合溶液中,Fe3+比Cu2+的溶解度更大,用该溶液作展开剂分离Fe3+和Cu2+的装置如图.以下叙述错误的是( )| A. | 该方法为径向纸上层析法 | B. | 试样点需浸没于展开剂中 | ||
| C. | 试样点晾干或电风吹干后才能补滴 | D. | 喷浓氨水内层圆环色斑呈绛蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
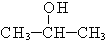 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O,产物不发生银镜反应;
+2H2O,产物不发生银镜反应; +H2$→_{△}^{催化剂}$
+H2$→_{△}^{催化剂}$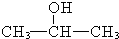 .
.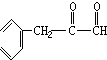 ,G与M是由不同方式形成的高分子化合物.
,G与M是由不同方式形成的高分子化合物.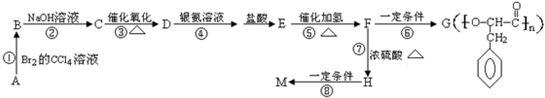
 .
.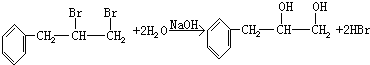 ,取代反应;
,取代反应; ,加聚反应.
,加聚反应.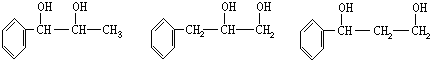
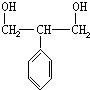 ,
,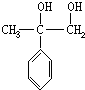 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
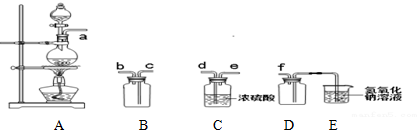
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
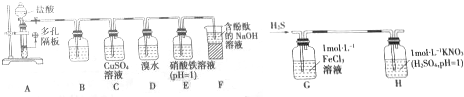
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
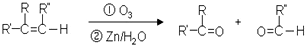
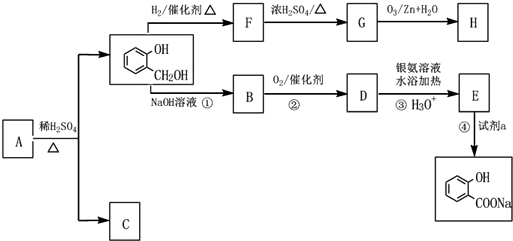
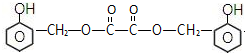 ,C俗称为草酸;
,C俗称为草酸;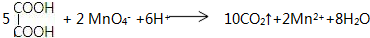 ; 写出C与对苯二甲醇在一定条件下发生缩聚反应的化学反应方程式:
; 写出C与对苯二甲醇在一定条件下发生缩聚反应的化学反应方程式: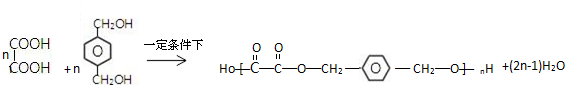 ;
; ;
; ;
;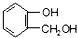 不能发生缩聚反应
不能发生缩聚反应 到F反应是否进行完全,可用FeCl3溶液检验
到F反应是否进行完全,可用FeCl3溶液检验 ;
;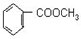 的最佳路线流程图(不参考答案能选用其他任何有机试剂,无机试剂任选). 流程图示例如下:
的最佳路线流程图(不参考答案能选用其他任何有机试剂,无机试剂任选). 流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
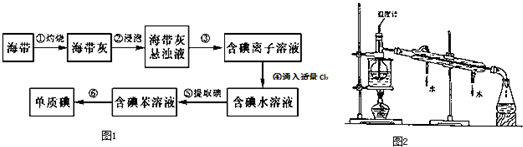
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com