
| 改变的条件 | 正、逆反应速率变化 | 新平衡与原平衡比较 | |
| A | 升高温度 | 逆反应速率增大量大于正反应速率增大量 | X的体积分数增大 |
| B | 增大压强 | 正反应速率增大,逆反应速率减小 | Z的浓度不变 |
| C | 减小压强 | 正、逆反应速率都减小 | Y的体积分数变大 |
| D | 充入一定 量的Z | 逆反应速率增大 | X的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.正反应为放热反应,升高温度,逆反应速率增大量大于正反应速率增大量,平衡向逆反应方向移动,X的体积分数增大;
B..反应前后气体的体积不变,增大压强,正逆反应速率都增大,平衡不移动移动,但体积减小,反应混合物各组分的浓度增大;
C.反应前后气体的体积不变,减小压强,正逆反应速率都减小,平衡不移动移动,各物质的体积分数不变;
D.充入一定量的Z,等效为在原平衡的基础上增大压强,正逆反应速率都增大,平衡不移动.
解答 解:A.正反应为放热反应,升高温度,逆反应速率增大量大于正反应速率增大量,平衡向逆反应方向移动,X的物质的量增大,混合气体总的物质的量不变,故X的体积分数增大,故A正确;
B.反应前后气体的体积不变,增大压强,正逆反应速率都增大,平衡不移动移动,但体积减小,Z的浓度增大,故B错误;
C.反应前后气体的体积不变,减小压强,正逆反应速率都减小,平衡不移动移动,各物质的体积分数不变,所以Y的体积分数不变,故C错误;
D.因为M为固体,所以充入一定量的Z,等效为成比例增加生成物,所以正逆反应速率都增大,平衡不移动,所以X的体积分数不变,故D错误,
故选A.
点评 本题考查化学平衡移动的影响因素,题目难度不大,B选项为易错点,学生容易认为平衡不移动反应混合物各组分的浓度不变.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
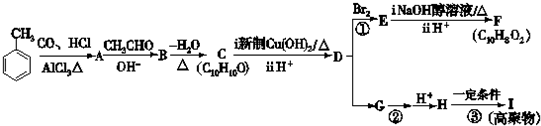
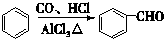
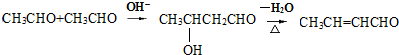
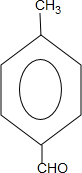 .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +nH2O.
+nH2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素原子组成的化合物不可能是离子化合物 | |
| B. | ⅠA族元素的金属性一定比ⅡA族元素的金属性强 | |
| C. | 同一主族元素组成的化合物一定是共价化合物 | |
| D. | NH5中的所有原子的最外层都符合相应稀有气体原子电子层结构,1 mol NH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由硫酸铁溶液与硫酸铵溶液按一定比例混合后蒸发结晶而得 | |
| B. | 此溶液中与下列粒子可以大量共存:H+、SO42-、I-、C6H5OH | |
| C. | 此溶液中离子浓度大小关系为:SO42->Fe3+>H+>OH- | |
| D. | 将含0.1 molNH4Fe(SO4)2溶液中滴加0.1 molBa(OH)2,反应的离子方程式为:Fe3++2SO42-+2Ba2++3OH-=2BaSO4↓+Fe(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com