
下列离子方程式正确的是( )
A.在FeSO4溶液中加入H2O2溶液:Fe2++2H2O2+4H+=Fe3++4H2O
B.向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++HCO3-+OH-═CaCO3↓+H2O
C.向FeBr2溶液中通入少量的氯气:2Br-+Cl2 = 2Cl-+Br2
D.向NaClO溶液中通入少量SO2:SO2 + ClO-+ H2O = SO42- + Cl- +2H+
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源:2015-2016学年广东省高二上第三次月考化学试卷(解析版) 题型:选择题
向沸水中滴加几滴饱和氯化铁溶液并继续煮沸至溶液呈红褐色时停止加热,此时当光束通过该红褐色液体时,从侧面可观察到一条光亮的“通路”说明该红褐色液体是
A. 溶液 B. 胶体 C. 悬浊液 D. 乳浊液
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上第三次模拟考试化学试卷(解析版) 题型:推断题
下图是元素周期表的框架,请在表中①~⑩元素中回答问题
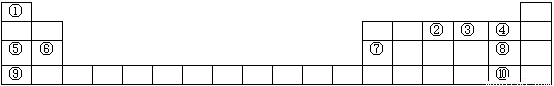
请用化学语言回答下列问题:
(1)在表中④、⑤、⑥三种元素的简单离子半径由大到小的顺序为__________________________。
(2)其中⑤与⑦两元素的最高价氧化物的水化物反应的离子方程式为_______________________。
(3)⑧与⑩两种元素非金属较强的是________,请用一个离子方程式证明该结论_________。
(4)①与③的两种单质可以在金属铂做电极时构成一种对环境友好的燃料电池,电解质为⑨的最高价氧化物的水化物,请书写出正极反应式_____________________,电池工作时阴离子定向移动到________极(填正或负)。
(5)元素①与⑧的两种单质在一定条件下可反应生成一种化合物甲,已知下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ),则生成1mol甲时释放的能量为____________kJ。
化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上第三次模拟考试化学试卷(解析版) 题型:选择题
某氖原子的质量是a g,12C原子的质量是bg用NA表示阿伏加德罗常数,则以下叙述中错误的是
A.该氖原子的相对原子质量为12a/b
B.Wg该氖原子的物质的量为W/aNA mol
C.Wg 该氖原子所含的质子数为 10W/a个
D.氖元素的摩尔质量为aNA g/mol
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省张掖市高三上第一次诊断考试理综化学试卷(解析版) 题型:填空题
CoCl2·6H2O是一种饲料营养强化剂。工业上利用水钴矿〔主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等〕制取CoCl2·6H2O的工艺流程如下:
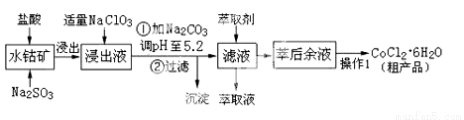
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)水钴矿进行预处理时加入Na2SO3的主要作用是 。
(2)写出NaClO3在浸出液中发生主要反应的离子方程式_______________________;
若不慎向“浸出液”中加了过量的NaClO3,可能会生成有毒气体,写出生成该有毒气体的离子方程式_____________________。
(3) “操作1”中包含3个基本实验操作,它们依次是_______________、________________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(4)浸出液加Na2CO3调pH至5.2时,过滤所得到的沉淀成分为 。
(5)萃取剂的作用是 。
(6)为测定粗产品中CoCl2·6H2O的含量,称取16.4克的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤,将沉淀烘干后称其质量为4.6克。则粗产品中CoCl2·6H2O的质量分数是________________。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期期中考试化学试卷(解析版) 题型:推断题
正盐A能发生下图所示的反应,图中①~⑧分别代表有关反应中的一种物质(某些物质已略去),其中①、②、④、⑤为无色气体。
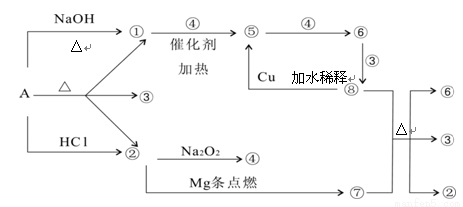
请完成下列各题:
(1)写出化学式A ⑥ ⑦
(2)写出下列反应方程式:
⑧+⑦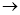 ②+③+⑥:
②+③+⑥:
①+④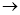 ⑤:
⑤:
(3)⑧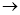 ⑤的离子方程式为:
⑤的离子方程式为:
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期期中考试化学试卷(解析版) 题型:选择题
重水(D2O)是重要的核工业原料,下列说法错误的是
A.氘(D)原子核外有1个电子 B.1H与D互称同位素
C.H2O与D2O互称同素异形体 D.1H218O与D216O的相对分子质量相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上12月月考化学试卷(解析版) 题型:填空题
用钠镁铝分别与盐酸反应填写下面几种情况的空白:
(1)称取相同质量的钠镁铝,然后分别与足量盐酸反应,则产生的氢气在通常条件下的体积之比为_____________。
(2)取相同物质的量的钠镁铝,分别与足量盐酸反应,则产生氢气质量之比为_________。
(3)如果要制取相同体积的氢气(同温同压下),与足量的盐酸分别反应时所消耗的钠镁铝的质量之比为________;物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上第三次段考化学试卷(解析版) 题型:选择题
相同温度下,体积均为0.25 L的两个恒容容器中发生可逆反应:
X2(g)+3Y2(g) 2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 放热46.3 kJ |
② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
下列叙述不正确的是
A.容器①、②中反应平衡时XY3的平衡浓度相同
B.容器①、②中达到平衡时各物质的百分含量相同
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于46.3 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com