
分析 (1)工业上用一氧化碳还原氧化铁炼铁;
(2)无论钢铁发生吸氧腐蚀还是析氢腐蚀,它们的共同特点是铁均为负极;为防止钢铁的腐蚀,要让钢铁做原电池的正极或电解池的阴极;
(3)合成材料主要有塑料、合成橡胶、合成纤维.
解答 解:(1)一氧化碳还原氧化铁生成铁和二氧化碳,方程式:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
故答案为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)无论钢铁发生吸氧腐蚀还是析氢腐蚀,它们的共同特点是铁均为负极,失电子发生氧化反应;为防止钢铁的腐蚀,要让钢铁做原电池的正极或电解池的阴极,故可以在船身上连接锌块,形成原电池,从而铁做原电池的正极而被保护,故答案为:氧化;锌块;
(3)三大合成材料是指:塑料、合成纤维、合成橡胶,
故答案为:合成纤维.
点评 本题考查可金属的腐蚀和防护以及三大合成材料等问题,难度不大,应注意的是金属的腐蚀中,无论钢铁发生吸氧腐蚀还是析氢腐蚀,钢铁均为负极.


科目:高中化学 来源: 题型:选择题
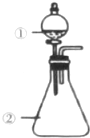 用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )| 选项 | ① | ② | 预测②中现象 | 实验结论 |
| A | 浓硫酸 | 浓盐酸 | 产生大量气体 | 硫酸的酸性比盐酸强 |
| B | 浓硫酸 | 铜片 | 铜片溶解,产生气泡,底部产生灰白色粉末 | 浓硫酸的酸性和强氧化性 |
| C | 浓硫酸 | CuSO4•5H2O | 固体由蓝色变为白色 | 浓硫酸具有吸水性,发生物理变化 |
| D | 浓硫酸 | 蔗糖 | 固体由白色变为黑色海绵状,并有刺激性气体放出 | 浓硫酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到干燥的有色布条上 | ||
| ③ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中 含有H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 利用所学化学知识解答问题:
利用所学化学知识解答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率与I2的浓度有关 | |
| B. | HI在反应Ⅰ中是氧化产物 | |
| C. | 反应焓变的绝对值等于190kJ•mol-1 | |
| D. | 乙醛的反应速率主要取决于反应Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
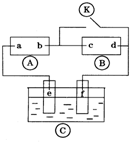 图
图 为直流电源,
为直流电源,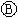 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,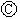 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现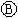 上的c点显红色,为实现铁上镀锌,接通
上的c点显红色,为实现铁上镀锌,接通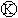 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | a为直流电源的负极 | B. | f电极为锌板 | ||
| C. | e极发生还原反应 | D. | c极发生的反应为2 H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
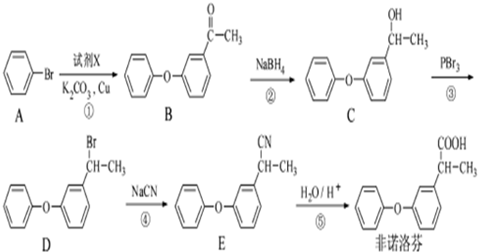
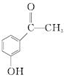 .
.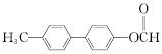 .
.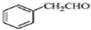 为原料制备
为原料制备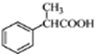 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③⑤ | C. | ①⑤ | D. | ②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏和煤的干馏都是物理变化 | |
| B. | 向蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,加水也不溶解 | |
| C. | 甲烷和氯气混合光照后黄绿色消失,是发生了加成反应 | |
| D. | 纤维素、淀粉都是天然高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com