
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向盛有1 mL浓硫酸的试管中加人5 mL 0 .1 mol/L的K2 Cr2 O7溶液 | 溶液橙 色变深 | 增大生成物浓度,平衡Cr2 O |
B | 向Mg(OH)2悬浊液中加人少量醋酸铵晶体 | 沉淀溶解,溶液变澄清 | 说明反应Mg2++2NH3·H2O |
C | 相同温度下,同时向①4mL0.1 mol/L. KMnO4),酸性溶液和②4 mL 0.2 mol/LKMnO4,酸性溶液中,分别加人4mL 1 mol/L. H2 C2 O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
D | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
A. A B. B C. C D. D
【答案】B
【解析】
A.浓硫酸密度大于水,溶于水放热,向盛有1 mL浓硫酸的试管中加人5 mL 0 .1 mol/L的K2 Cr2O7溶液容易发生迸溅,且溶液温度升高无法判断平衡移动方向,故A错误;
B.铵根离子可结合氢氧化镁电离出的氢氧根离子,发生 Mg(OH)2+2NH4+ Mg2++2NH3·H2O ,说明反应Mg2++2NH3·H2O Mg(OH)2+2NH4+具有可逆性,故B正确;
B.由于KMnO4溶液本身有颜色,会影响实验现象的观察,故探究浓度对化学反应速率的影响,应用不同浓度的草酸与相同浓度的KMnO4溶液,故C错误;
D.C燃烧生成二氧化碳,能量变化与途径无关,则煤炭燃烧放出热量不变,结论不合理,故D错误。
所以B选项是正确的。


科目:高中化学 来源: 题型:
【题目】(1)科研人员设想用如图所示装置生产硫酸。
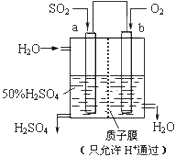
①上述生产硫酸的总反应方程式为____,b是____极(填“正”或“负”),b电极反应式为_____,a电极发生_____。(填“氧化反应”或“还原反应”)
②生产过程中H+向___(填 a 或 b)电极区域运动。
(2)将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,可构成甲烷燃料电池,已知通入甲烷的一极,其电极反应式为:_______,该燃料电池总反应式为:_____ ,电池在放电过程中溶液的pH将______(填“下降”或“上升”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+I2(g)![]() 2HI(g)△H<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
2HI(g)△H<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
A. 甲、乙提高相同温度
B. 甲中加入0.1molHe,乙中不变
C. 甲降低温度,乙增大压强
D. 甲增加0.1molH2,乙增加0.1molI2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g铜镁合金完全溶解于50mL 密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,求:
(1)该浓硝酸中HNO3的物质的量浓度?
(2)该合金中铜与镁的物质的量之比?
(3)NO2和N2O4的混合气体中,它们的体积分数分别是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示

下列说法正确的悬
A. △H1<0,△H2>0
B. 反应①②③的反应热满足关系:△H2-△H1=△H3
C. 反应①②③的平衡常数满足关系;K1·K2=K3
D. 要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A.烷烃的取代反应和烯烃的加成反应均能生成卤代烃
B.苯乙烯在合适条件下催化加氢可生成乙基环己烷
C.乙烯与溴的四氯化碳溶液反应生成1,2二溴乙烷
D.苯分子的六个碳碳键完全相同,六个碳氢键不相同,能发生加成反应和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14 分) 铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中。
(1)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3]。则该反应的化学方程式为:
。
(2)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。

①A 点时剩余固体的成分是 (填化学式)。B 点时剩余固体的成分是 (填化学式)
②从开始加热到 750K时总反应方程式为 。
(3)CrO3和 K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成 Fe(OH)3 和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①电解过程中 NaCl 的作用是__________________________。
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1,则溶液中c(Cr3+)为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 保存FeCl2溶液时,应在试剂瓶中加入少量铁粉
B. 焰色反应时,铂丝需用稀硫酸洗净,并在火焰上灼烧至无色
C. 蒸馏时加入沸石的目的是为了防止暴沸
D. 使用容量瓶配制溶液定容时仰视刻度线会使得所配溶液浓度偏小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com