
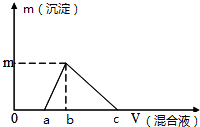
 往100mL0.1mol/L NaOH溶液中逐滴滴入浓度均为0.1mol/L的氯化铝和盐酸的混合溶液,测得生成沉淀的质量(g)与滴入的混合液的体积(mL)的关系如图所示,则下列说法正确的是( )
往100mL0.1mol/L NaOH溶液中逐滴滴入浓度均为0.1mol/L的氯化铝和盐酸的混合溶液,测得生成沉淀的质量(g)与滴入的混合液的体积(mL)的关系如图所示,则下列说法正确的是( )| A. | a=25mL | B. | b=33mL | C. | c=100mL | D. | m=0.195g |
分析 100mL0.1mol/L NaOH溶液中含有NaOH的物质的量为:0.1mol/L×0.1L=0.01mol,
a点时氢氧化钠与氯化铝、盐酸恰好反应生成偏铝酸钠和NaCl,设溶液体积为x,则:0.1x×4+0.1x=0.01,解得:x=0.02L=20mL,即a=20;
b点时氢氧化钠与氯化铝、盐酸恰好反应生成氢氧化铝沉淀和NaCl,设此时加入混合液体积为y,则0.1y×3+0.1y=0.01,解得:y=0.025L=25mL,即b=25;根据铝元素守恒可知生成氢氧化铝沉淀的物质的量为:0.1mol/L×0.025L=0.0025mol,氢氧化铝的质量为:78g/mol×0.0025mol=0.195g;
c点时刚好没有沉淀生成,说明盐酸与氢氧化钠恰好反应,则加入混合液体积为:$\frac{0.01mol}{0.1mol/L}$=0.1L=100mL,即c=100;
据此进行解答.
解答 解:100mL0.1mol/L NaOH溶液中含有NaOH的物质的量为:0.1mol/L×0.1L=0.01mol,
A.根据图象可知:a点时氢氧化钠与氯化铝、盐酸恰好反应生成偏铝酸钠和NaCl,设溶液体积为x,则:0.1x×4+0.1x=0.01,解得:x=0.02L=20mL,即a=20,故A错误;
B.b点时氢氧化钠与氯化铝、盐酸恰好反应生成氢氧化铝沉淀和NaCl,设此时加入混合液体积为y,则0.1y×3+0.1y=0.01,解得:y=0.025L=25mL,即b=25,故B错误;
C.c点时刚好没有沉淀生成,说明盐酸与氢氧化钠恰好反应,则加入混合液体积为:$\frac{0.01mol}{0.1mol/L}$=0.1L=100mL,即c=100,故C正确;
D.结合B可知c点时加入25mL混合液,根据铝元素守恒可知生成氢氧化铝沉淀的物质的量为:0.1mol/L×0.025L=0.0025mol,氢氧化铝的质量为:78g/mol×0.0025mol=0.195g,故D正确;
故选CD.
点评 本题考查了混合物反应的计算,题目难度中等,明确图象曲线变化的含义及对应反应为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 摩尔是把物质的质量和微观粒子数联系起来的一个基本物理量 | |
| B. | 1摩尔H2SO4的质量为98g/mol | |
| C. | 国际上规定,0.012 kg 碳原子所含有的碳原子数目为 1 mol | |
| D. | 1摩尔氢气分子可以表示为1mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2Mn2O7→4NaMnO4+O2↑ | B. | 2Na2O2+P2O3→Na4P2O7 | ||
| C. | 2Na2O2+2 N2O3→NaNO2+O2↑ | D. | 2 Na2O2+2 N2O5→4NaNO3+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
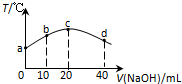 常温下,若往20mL 0.01mol•L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
常温下,若往20mL 0.01mol•L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | 所加烧碱溶液PH=12,c点水的离子积常数KW=10-14 | |
| C. | c点混合溶液中:c(OH-)>c(HNO2) | |
| D. | d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量就是物质的质量 | |
| B. | 氧气的摩尔质量为32g | |
| C. | 摩尔是国际单位制的七大基本物理量之一 | |
| D. | 同温同压下,分子数相同的任何气体体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)/c(H+)=10-12的溶液中:K+、Ba2+、Br-、Cl- | |
| B. | 0.1mol•Lˉ1NaHC2O4溶液中:K+、Ba2+、OH-、Cl- | |
| C. | pH=7的溶液中:Fe3+、Na+、Cl-、NO3- | |
| D. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素均为天然高分子化合物 | |
| B. | 饮用矿泉水瓶的主要成分是聚氯乙烯 | |
| C. | 厨房中用的食盐、食醋都是电解质 | |
| D. | 大米煮成粥后,淀粉就变成了葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com