
 氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.分析 (1)组成氧硫化碳和磷化氢的原子为O、S、P、H,先判断电子层数,电子层数越多,原子半径越大;电子层数相同,再根据元素周期律,同周期元素的原子半径随着原子序数的增大而减小,主族元素周期数=电子层数,主族序数=最外层电子数;
(2)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度、氢化物的稳定性以及最高正价氧化物对应水化物酸性强弱;
(3)①每吸收1.7g H2S气体,反应放出热烈4.76KJ,标注物质的聚集状态和对应反应的焓变写出热化学方程式;
②由信息可知,硫离子和水反应生成硫代硫酸根离子和氢气,依据电荷守恒和原子守恒书写离子反应方程式;
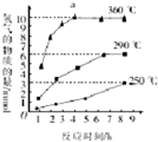
③根据图示反应时间与H2产量的关系,a点时M溶液中除S2O32-外,还有SO42-.
解答 解:(1)组成氧硫化碳和磷化氢的原子为O、S、P、H,氢元素有1个电子层,氧元素有2个电子层,磷、硫有3个电子层,所以磷、硫的原子半径大于氢、氧的原子半径,磷、硫是同周期元素,硫的原子序数大于磷的原子序数,由元素周期律知,磷的原子半径大于硫的原子半径,磷最外层为5个电子,处于第三周期第VA族,
故答案为:第三周期第VA族;
(2)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度、氢化物的稳定性以及最高正价氧化物对应水化物酸性强弱等角度,而最高正化合价、氢化物的沸点高低不能用于比较元素的非金属性强弱,
故选b;
(3)①反应Ⅱ为硫化氢和氢氧化钠的反应H2S+2NaOH=Na2S+H2O,1.7g H2S的物质的量为n=0.5mol,反应放出热量4.76kJ,则1mol硫化氢反应放出95.2KJ的热量,所以该反应的热化学方程式为H2S(g)+2NaOH(aq)=Na2S(aq)+2H2O(l)△H=-95.2KJ/mol,
故答案为:H2S(g)+2NaOH(aq)=Na2S(aq)+2H2O(l)△H=-95.2KJ/mol;
②由信息可知,硫离子和水反应生成硫代硫酸根离子和氢气,根据硫原子守恒,产物需有因离子,根据原子守恒,产物还有氢氧根离子,离子反应为2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,
故答案为:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-;
③反应Ⅲ中,a点360℃时,随着时间推移,氢气的量不变,Na2S初始含量为3mmol,若只发生:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,生成氢气:3mmol×2=6mmol,图中为9mmol,说明M溶液中除S2O32-外,还有SO42-,离子反应为S2-+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$SO42-+4H2↑,
故答案为:SO42-.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质、元素周期律、热化学方程式、离子方程式为解答的关键,侧重分析与应用能力的考查,注意含硫物质的性质及规律性知识的应用,题目难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
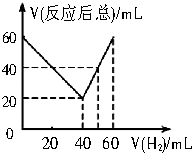 某气态不饱和链烃CnHm与H2反应生成CnHm+n,取CnHm和H2混合气体共60mL进行实验,发现随混合气中H2所占体积的变化,反应后得到的气体总体积数也不同.反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温同压下测定).由此可知n的数值是( )
某气态不饱和链烃CnHm与H2反应生成CnHm+n,取CnHm和H2混合气体共60mL进行实验,发现随混合气中H2所占体积的变化,反应后得到的气体总体积数也不同.反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温同压下测定).由此可知n的数值是( )| A. | 2 | B. | 4 | C. | 6 | D. | 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | O | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的焓变为负值 | |
| B. | 化学方程式为 NO2(g)+CO(g)?CO2(g)+NO(g) | |
| C. | 降温,正反应速率减小 | |
| D. | 恒温时,增大压强颜色加深,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
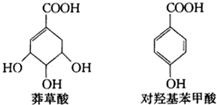 以莽草酸为原料,经多步反应可制取对羟基苯甲酸.莽草酸、对羟基苯甲酸的结构简式如图.下列说法正确的是( )
以莽草酸为原料,经多步反应可制取对羟基苯甲酸.莽草酸、对羟基苯甲酸的结构简式如图.下列说法正确的是( )| A. | 莽草酸、对羟基苯甲酸都属于芳香族化合物 | |
| B. | 1mol莽草酸与NaOH溶液反应,最多消耗4 mol NaOH | |
| C. | 利用FeCl3溶液可鉴别莽草酸和对羟基苯甲酸 | |
| D. | 对羟基苯甲酸较稳定,在空气中不易被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com