
 I.铁是人体必须的微量元素,绿矾(FeSO4?7H2O)是治疗缺铁性贫血药品的重要成份.
I.铁是人体必须的微量元素,绿矾(FeSO4?7H2O)是治疗缺铁性贫血药品的重要成份.| 250 |
| 25 |
| 5.56g |
| 5.7g |


科目:高中化学 来源: 题型:
| A、②③⑤ | B、②③④ |
| C、②④⑥ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
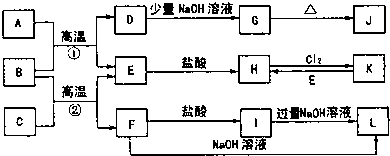
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有25℃时0.1mol?L-1的氨水和0.1mol?L-1的NaOH溶液,若向各20mL的氨水和NaOH溶液中分别滴加0.1mol?L-1的稀盐酸,滴定曲线如图所示,请回答以下问题.
现有25℃时0.1mol?L-1的氨水和0.1mol?L-1的NaOH溶液,若向各20mL的氨水和NaOH溶液中分别滴加0.1mol?L-1的稀盐酸,滴定曲线如图所示,请回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 近期曝出的“毒大米”事件,引起了国人的震惊和忧虑,又一次把环境问题摆在了我们面前.“毒大米”是由镉污染引起的,会对人体健康造成严重危害.镉元素在元素周期表中的图示如图所示.
近期曝出的“毒大米”事件,引起了国人的震惊和忧虑,又一次把环境问题摆在了我们面前.“毒大米”是由镉污染引起的,会对人体健康造成严重危害.镉元素在元素周期表中的图示如图所示.| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是在0.1mol?L-1Na2CO3溶液中逐滴加入1mol-1?L-1HC1的反应过程中含碳组分含量与溶液pH变化关系图,下列描述不正确的是( )
如图是在0.1mol?L-1Na2CO3溶液中逐滴加入1mol-1?L-1HC1的反应过程中含碳组分含量与溶液pH变化关系图,下列描述不正确的是( )A、由图可知CO
| ||||
B、pH=8时溶液中只有HCO
| ||||
C、碳酸氢钠溶液中滴加少量Ba(OH)2溶液反应的离子方程式:2HCO
| ||||
D、pH=7时反应的离子方程式:H++HCO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 相关实验 | 预期目的 | |
| A | 相同温度下,等质量的大理石块、大理石粉分别与等湾积、等浓度的盐酸反应 | 探究接触面积对化学反应速率的影响 |
| B | 把装有颜色相同的NO2和N2O4混合气的两支试管(密封)分别浸入冷水和热水中 | 探究温度对化学平衡的影响 |
| C | 在蔗糖中加入稀硫酸,水浴加热,再加入新制的氢氧化铜并加热 | 探究蔗糖水解产物具有还原性 |
| D | 两支试管中装有等体积、等浓度H2O2溶液,向其中一支试管中加入FeCl3溶液 | 探究FeCl3溶液对H2O2分解速率的影响 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com