
分析 氯化铁为强酸弱碱盐,水解呈酸性;配制氯化铁溶液时滴加少量盐酸的作用是抑制氯化铁的水解;若向氯化铁溶液中加入碳酸钙粉末,碳酸钙粉末和氯化铁的酸性溶液中的氢离子反应,使c(H+)减小,引起水解平衡向右移动,导致Fe(OH)3增多,形成红褐色沉淀;因氯化氢易挥发,所以把FeCl3 溶液蒸干后得氢氧化铁沉淀,再灼烧,最后得到的主要固体产物是Fe2O3.
解答 解:FeCl3为强酸弱碱盐,Fe3+离子水解使溶液呈酸性,水解方程式为Fe3++3H2O?Fe(OH)3+3H+;
在配制FeCl3的溶液时,滴加少量盐酸,防止Fe3+水解;
若向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐逐渐溶解,并产生无色气体,是由于FeCl3为强酸弱碱盐,Fe3+离子水解使溶液呈酸性,CaCO3与水解平衡中的H+反应CaCO3+2H+=Ca2++H2O+CO2↑,使c(H+)减小,引起水解平衡向右移动,导致Fe(OH)3增多,形成红褐色沉淀;
FeCl3为强酸弱碱盐,水解生成Fe(OH)3和盐酸,盐酸易挥发,FeCl3溶液在加热时促进Fe3+的水解,水解后生成Fe(OH)3,加热分解生成Fe2O3,
故答案为:Fe3++3H2O?Fe(OH)3 +3H+;抑制氯化铁的水解;CaCO3+2H+=Ca2++H2O+CO2↑;CaCO3与上述水解平衡中的H+反应,使c(H+)减小,引起水解平衡向右移动,导致Fe(OH)3增多,形成红褐色沉淀;Fe2O3.
点评 本题考查盐类水解的应用,注意盐类水解的原理是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LCH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| C. | 配制FeCl3溶液,应加少量盐酸 | |
| D. | 将Al2(SO4)3溶液蒸干,灼烧得Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
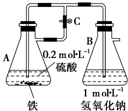 当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:
当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于10秒 | B. | 等于12秒 | C. | 大于12秒 | D. | 小于12秒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥⑨ | B. | ①②③④ | C. | ⑥⑦⑧⑨ | D. | ③④⑤⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表而镀铜可以增强其抗腐蚀性 | |
| B. | 用高温催化氧化法去除烃类废气(CxHy):CxHy+(x+$\frac{y}{4}$)O2$→_{高温}^{催化剂}$xCO2+$\frac{y}{2}$H2O | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 废旧电池中含有的重金属离子对水和土壤会造成污染,因而不能随意丢弃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砖块中的主要成分是硅酸盐 | |
| B. | 青砖中的铁元素主要以氢氧化亚铁的形式存在 | |
| C. | 红砖中的铁元素主要以氧化铁的形式存在 | |
| D. | 青砖中的铁元素主要以氧化亚铁的形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
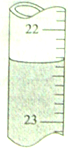 准确移取25.00mL某未知浓度的NaOH溶液于一洁净锥形瓶中,然后用0.20mol/L的盐酸溶液滴定(指示剂为甲基橙),滴定结果如下:
准确移取25.00mL某未知浓度的NaOH溶液于一洁净锥形瓶中,然后用0.20mol/L的盐酸溶液滴定(指示剂为甲基橙),滴定结果如下:| HCl溶液起始读数 | HCl溶液终点读数 | |
| 第一次 | 2.15mL | |
| 第二次 | 3.10mL | 21.85mL |
| 第三次 | 4.20mL | 22.95mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com