
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的$\frac{3}{8}$ |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
分析 短周期元素中,T原子最外层电子占核外电子总数的$\frac{3}{8}$,则T为S元素;X元素原子最外电子数是次外层电子数的2倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素;Y元素常温下单质为双原子分子,其氢化物的水溶液呈碱性,则Y为氮元素;Z元素最高正化合价是+7,最外层电子数为7,则Z为Cl元素,据此解答.
解答 解:短周期元素中,T原子最外层电子占核外电子总数的$\frac{3}{8}$,则T为S元素;X元素原子最外电子数是次外层电子数的2倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素;Y元素常温下单质为双原子分子,其氢化物的水溶液呈碱性,则Y为氮元素;Z元素最高正化合价是+7,最外层电子数为7,则Z为Cl元素.
(1)碳元素的一种同位素可测定文物年代,这种同位素的符号是614C,故答案为:614C;
(2)Y元素的气态氢化物为氨气,检验氨气的方法和现象是:用湿润的红色石蕊试纸检验,试纸变蓝,
故答案为:用湿润的红色石蕊试纸检验,试纸变蓝;
(3)Z素与氢元素、氧元素形成的化合物HClO具有漂白性,其结构式为H-O-Cl,故答案为:H-O-Cl;
(4)T、X、Y、Z四种元素的最高价氧化物对应水化物分别为H2SO4、H2CO3、HNO3、HClO4,H2CO3是弱酸,其余均为强酸,
故答案为:H2CO3;H2CO3是弱酸,其余均为强酸;
(5)将T元素的氧化物SO2和Z的单质氯气同时通入水中,可发生反应,该反应化学方程式为:Cl2+SO2+2H2O=2HCl+H2SO4,
故答案为:Cl2+SO2+2H2O=2HCl+H2SO4.
点评 本题考查结构性质位置关系、核外电子排布规律、元素化合物性质等,难度不大,推断元素是解题关键,注意基础知识的理解掌握.


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑥ | C. | ③④ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度过高对合成氨不利 | |
| B. | 合成氨在高压下进行是有利的 | |
| C. | 高温及加入催化剂都能使合成氨的反应速率加快 | |
| D. | 增加N2的浓度可提高平衡混合物中NH3的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2和Na2CO3 | B. | 稀盐酸和Na[Al(OH)4] | C. | 稀盐酸和Na2CO3 | D. | NaOH和AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
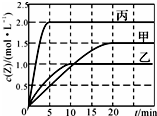 向甲、乙、丙三个容积固定不变的密闭容器中充入一定量的X和Y,一定条件下发生反应 X(g)+aY(g)?2Z(g).各容器的反应温度、反应物起始量、反应过程中Z的浓度随时间变化分别以如图和下表来表示.下列说法不正确的是( )
向甲、乙、丙三个容积固定不变的密闭容器中充入一定量的X和Y,一定条件下发生反应 X(g)+aY(g)?2Z(g).各容器的反应温度、反应物起始量、反应过程中Z的浓度随时间变化分别以如图和下表来表示.下列说法不正确的是( ) | 容器 | 甲 | 乙 | 丙 | |
| 容积/L | 0.5 | 0.5 | 1.0 | |
| 温度/℃ | T1 | T2 | T2 | |
| 反应物起始量 | 1.0 mol X 0.5 mol Y | 1.0 mol X 0.5 mol Y | 4.0 mol X 2.0 mol Y |
| A. | 该反应温度升高,平衡常数减小 | |
| B. | 20 min内甲容器中反应的平均速率:v(X)=0.0375mol•(L•min)-1 | |
| C. | 10 min时,其他条件不变,向乙容器中再加入2 mol Z,平衡向逆反应方向移动 | |
| D. | 其他条件不变,若缩小乙的体积,Y的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向被污染的土壤洒石灰 | |
| B. | 向远离污染源的高处撤离 | |
| C. | 用浸有纯碱溶液的毛巾捂住口鼻迅速撤离 | |
| D. | 来不及撤离时可用纯碱溶液浸湿的棉被堵好门窗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com