(《物质结构与性质》)
(1)金属镁有许多重要的用途,法国化学家维多克?格利雅因发明了在有机合成方面用途广泛的格利雅试剂而荣获诺贝尔化学奖,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如图:
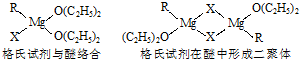
①上述2种结构中均存在配位键,把你认为是配位键的用“→”标出
.
②由原子间的成键特点,可以预测中心原子Mg的杂化类型可能为
;Mg原子的核外电子排布式可表示为
.
③下列比较中正确的是
A.金属键的强弱:Mg>Al B.基态原子第一电离能:Mg>Al
C.金属性:Mg>Al D.晶格能:NaCl>MgCl
2(2)将TiCl
4在氩气保护下与镁共热得到钛:TiCl
4+2Mg
Ti+2MgCl
2①Ti元素在元素周期表中的位置是
,钛原子的外围电子排布式为
.
②TiCl
4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟.则TiCl
4属于
(填“原子”、“分子”或“离子”)晶体.
③二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是
.
A.苯与B
3N
3H
6互为等电子体
B.甲醛、苯分子中碳原子均采用sp
2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
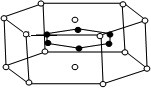
(3)2001年报导的硼和镁形成的化合物刷新了金属化合物超导温度的最高纪录.如图中示意的该化合物的晶体结构单元:镁原子间形成正六棱柱,则棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内,则该化合物的化学式可表示为
A.MgB B.MgB
2 C.Mg
2B D.Mg
3B
2.




