
| A. | 乙烯通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色 | |
| B. | 含碳原子较多的烷烃加热、加压、催化剂条件下反应生成含碳原子较少的烷烃和烯烃 | |
| C. | 在光照条件下,C2H6与Cl2反应生成了油状液体 | |
| D. | 在催化剂作用下,乙烯与水反应生成乙醇 |
科目:高中化学 来源: 题型:选择题
| A. | 形成lmolH-Cl键放出的能量 | B. | 石墨转变成金刚石吸收的能量 | ||
| C. | 1molO2形成2mo1O原子吸收的能量 | D. | 水蒸气变成液态水放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯制成的塑料可以反复加热熔融,是热塑性材料 | |
| B. | 用碱催化生成的酚醛树脂能形成网状结构,不溶于任何溶剂 | |
| C. | 在制备高吸水性树脂时要加入交联剂,以得到具有网状结构的树脂 | |
| D. | 天然纤维的主要成分都是纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
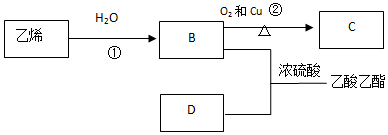
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com