
| A. | 相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为11:7 | |
| B. | 同体积、同密度的C2H4和CO,两种气体的分子数一定相等 | |
| C. | 配制450ml0.1mol•L-1的NaOH溶液,用托盘天平称取NaOH固体1.8g | |
| D. | 1L0.45mol•L-1NaCl溶液中Cl-的物质的量浓度比0.1L0.15mol•L-1AlCl3溶液大 |
分析 A.依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$结合一氧化碳、二氧化碳分子构成解答;
B.依据m=ρV结合C2H4和CO具有相同摩尔质量解答;
C.配制450ml溶液应选择500mL容量瓶,依据m=CVM计算需要溶质的质量;
D.溶液浓度与体积无关,0.45mol•L-1NaCl溶液中Cl-的物质的量浓度为0.45mol/L;0.15mol•L-1AlCl3溶液氯离子浓度为0.15mol/L×3=0.45mol/L.
解答 解:A.1个一氧化碳含有1个氧原子,1个二氧化碳含有2个氧原子,相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为$\frac{m}{28}$×1×NA:$\frac{m}{44}$×2×NA=11:14,故A错误;
B.C2H4和CO摩尔质量相等,依据m=ρV可知同体积、同密度的C2H4和CO,两种气体物质的量相等,依据N=nNA,二者具有相同的分子数,故B正确;
C.配制450ml0.1mol•L-1的NaOH溶液,应选择500mL容量瓶,用托盘天平称取NaOH固体0.5L×0.1mol/L×40g/mol=2.0g,故C错误;
D.溶溶液浓度与体积无关,0.45mol•L-1NaCl溶液中Cl-的物质的量浓度为0.45mol/L;0.15mol•L-1AlCl3溶液氯离子浓度为0.15mol/L×3=0.45mol/L,所以1L0.45mol•L-1NaCl溶液中Cl-的物质的量浓度与0.1L0.15mol•L-1AlCl3溶液中氯离子的物质的量浓度相等,故D错误.
故选B.
点评 本题考查了物质的量有关计算,熟悉以物质的量为核心计算公式是解题关键,注意物质的结构组成,注意配制一定物质的量浓度溶液中容量瓶规格选择及使用注意事项,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 200 mL | B. | 300 mL | C. | 600 mL | D. | 700 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验① | 实验② | 实验③ |
| 将铁钉放入硫酸 铜溶液中 | 向硫酸亚铁溶液中 滴入几滴浓硝酸 | 将铜丝放入 氯化铁溶液中 |
| A. | 可以用实验①的方法冶炼铜 | |
| B. | 实验②中Fe2+既显氧化性又显还原性 | |
| C. | 实验③中发生置换反应 | |
| D. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 操作 | 现象 |
| A | BaSO3难溶于水 | 将SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 |
| B | 验证非金属性:Br>I | 将溴水滴加到淀粉KI溶液中 | 溶液变蓝 |
| C | 验证SO2的漂白性 | 将SO2通入酸性KMnO4溶液中 | KMnO4溶液褪色 |
| D | 验证某化合物一定是钠盐 | 该化合物在酒精灯上灼烧 | 焰色为黄色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂为KMnO4,其中Cl元素被还原 | |
| B. | 若有0.8molH2O生成,则反应中有NA个电子转移 | |
| C. | 浓HCl在反应中起酸性和还原性的作用 | |
| D. | 由此反应可以大胆推测氧化性强弱关系:KMnO4>MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2溶于水:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 向氧化铁中加入氢碘酸发生反应:Fe2O3+6HI═2Fe2++I2+3H2O+4I- | |
| C. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 漂白粉溶液中通入过量的CO2:ClO-+CO2+H2O═HClO+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
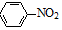 +4Mg+8CH3OH→
+4Mg+8CH3OH→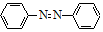 +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
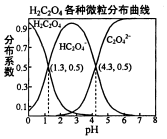 常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数〔分布系数)随PH变化的关系如图所示.下列表述不正确的是( )
常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数〔分布系数)随PH变化的关系如图所示.下列表述不正确的是( )| A. | HC2O4-?H++C2O42-,K=1×10-4.3 | |
| B. | 将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液PH恰好为4.3 | |
| C. | 常温下HF的KB=1×10--3.45,将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4- | |
| D. | 在0.1mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com