
����Ŀ��ͼ�У�AΪһ����ѧ��ѧ�г����ĵ��ʣ�B��C��D��E�Ǻ���AԪ�صij�����������ǵ���ɫʵ���Ϊ��ɫ��

��1��д���������ʵĻ�ѧʽ��B___��
��2������6����Ӧ������������ԭ��Ӧ����___(��д���)��
��3��д��A ��C��Ӧ�����ӷ���ʽ___��
��4��д��B��C��Ӧ�����ӷ���ʽ��___��E��D�Ļ�ѧ����ʽ��___��
��5������5.00gD��E�Ĺ������ʹE��ȫ�ֽ⣬�������������������0.31g����ԭ�������D����������Ϊ___��
���𰸡�Na2O2 �٢ڢۢ� 2Na+2H2O=2Na++2OH-+H2�� 2Na2O2��2H2O��4Na����4OH����O2�� 2NaHCO3![]() Na2CO3��CO2����H2O 83.2%
Na2CO3��CO2����H2O 83.2%
��������
AΪһ����ѧ��ѧ�г����ĵ��ʣ���ɫʵ��Ϊ��ɫ����AΪNa��Na��������ȼʱ���ɹ������ƣ���BΪNa2O2�����������������̼��Ӧ����̼���ƣ���DΪ̼���ƣ�Na��ˮ��Ӧ����C����CΪNaOH��NaOH������Ķ�����̼��Ӧ����̼�����ơ�
��1��������֪��BΪ�������ƣ���ѧʽΪNa2O2��
��2��Na��ˮ��������Ӧʱ�����ϼ۷����ı䣬Ϊ������ԭ��Ӧ�����������������̼��ˮ��Ӧ���ɵ������������ϼ۸ı䣬Ϊ������ԭ��Ӧ��NaOH�������̼��̼����������̼���ƻ��ϼ�δ�䣬Ϊ��������ԭ��Ӧ��
��3��A ��C�ֱ�ΪNa��NaOH��Na��ˮ��Ӧ�����������ƺ����������ӷ���ʽΪ2Na+2H2O=2Na++2OH-+H2����
��4������������ˮ��Ӧ�����������ƺ����������ӷ���ʽΪ2Na2O2��2H2O��4Na����4OH����O2����̼���������ȷֽ�����̼���ơ�������̼��ˮ������ʽΪ2NaHCO3![]() Na2CO3��CO2����H2O��
Na2CO3��CO2����H2O��
��5�����ݷ���ʽ���ٵ�����Ϊ1��1��CO2��H2O����n��NaHCO3��=2n��CO2��=![]() =0.005mol��2��m��NaHCO3��=0.010mol��84g/mol=0.84g��m��Na2CO3��=5.00g-0.84g=4.16g��Na2CO3��������Ϊ
=0.005mol��2��m��NaHCO3��=0.010mol��84g/mol=0.84g��m��Na2CO3��=5.00g-0.84g=4.16g��Na2CO3��������Ϊ![]() ��100%=83.2%��
��100%=83.2%��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ���ͼ�жϣ�����˵����ȷ���ǣ���

A.װ������װ�����и�����Ӧ����Fe��2e��=Fe2+
B.װ������������Ӧ��O2��2H2O��4e��=4OH��
C.װ������װ�����������е������Ӿ����Ҳ��ձ��ƶ�
D.�ŵ�����У�װ��������ձ���װ�����Ҳ��ձ�����Һ��pH�ֱ�����ͼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������0.5LijȪˮ��Ʒ�����к���Ca2+0.02g������㣺
��1����Ȫˮ��Ʒ��Ca2+�����ʵ���Ũ���Ƕ���___��
��2��Ϊʹ��Ȫˮ��Ʒ��������Ca2+ȫ������������Ӧ����Na2CO3�����ʵ����Ƕ���___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������amol�����ƺ�bmol�������ĺϽ�Ͷ��mg����ˮ�У���ȫ�ܽ⣬����ʣ�࣬������Һ�ܶ�Ϊdgcm��3��������ؼ���ʽ���д�����ǣ�������
A.NaOH�����ʵ�������a��b��mol
B.NaAlO2�����ʵ���Ũ�ȣ�![]() mol/L
mol/L
C.���������H2�������![]() L
L
D.�μӷ�Ӧ��ˮ��������18��a+1.5b��g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1mol CH4���������������ܱ������е�ȼ����ַ�Ӧ�������������ʣ�࣬�Ҳ����Ϊ���� (101 kPa��120��)����������Ϊ72g�������й���������ȷ����
A. ��������ͨ����ʯ�ң�����ȫ�������գ���ͨ��Ũ���ᣬ����ȫ��������
B. �����ƽ��Ħ������Ϊ42g/mol
C. ��������ͨ��Ũ���������պ�ָ���101kPa��120�棬��ѹǿ��Ϊԭ����1/3
D. ��Ӧ����������Ϊ56g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ժ���Ca2+��Mg2+��Cl-��SO42-��Br-�����ӵ�±ˮΪ��Ҫԭ���Ʊ���ˮCaCl2��Br2���������£�
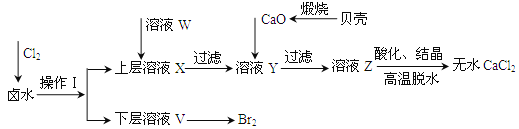
��1��������ʹ�õ��Լ���______�����õ���Ҫ����������_____��
��2��������ҺW��Ŀ����______����CaO������ҺY��pH�����Գ�ȥMg2+���ɱ������ݿ�֪�������Ͽ�ѡ���pH���Χ��______���ữ��ҺZʱ��ʹ�õ��Լ�Ϊ______��
��ʼ����ʱ��pH | ������ȫʱ��pH | |
Mg2+ | 9.6 | 11.0 |
Ca2+ | 12.2 | c��OH-��=1.8molL-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������0.1molL��1������Һ��pH=a��������ʹ��ҺpH=��a+1���Ĵ�ʩ��
A. ����Һϡ�͵�ԭ�����2��B. ���������Ĵ����ƹ���
C. ��������0.2 molL��1����D. ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ 2KMnO4 + 16HCl =2KCl + 2MnCl2 + 5Cl2�� + 8H2O ������ʵ������ȡ������
(1)�÷�Ӧ��______����������_____���������_____Ԫ�ر���ԭ��
(2)Ũ�����ڷ�Ӧ����ʾ������������________(�����)��
��ֻ�л�ԭ�� �ڻ�ԭ�Ժ����� ��ֻ�������� �������Ժ�����
(3)����˫���Ż����ű�����з�Ӧ�ĵ���ת�Ʒ������Ŀ2KMnO4 + 16HCl = 2KCl + 2MnCl2+ 5Cl2��+ 8H2O_____________________
���ڱ�״���£��÷�Ӧ����2.24 L Cl2ʱ������������_____mol�������������ʵ�����Ϊ_____g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.Ǧ�����ڷŵ�����У������õ����ӣ��缫��������
B.0.1mol/L CH3COOH��Һ��ˮϡ�ͺ���Һ��![]() ��С
��С
C.SiO2(s)��2C(s)=Si(s)��2CO(g)�����ڸ����·�Ӧ���ܷ���������H>0
D.�ϳɰ������н�NH3Һ�����룬�ɼӿ�����Ӧ���ʣ����H2��ת����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com