
| A. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| B. | 硝酸铷是离子化合物 | |
| C. | 它位于周期表的第四周期、第ⅠA族 | |
| D. | 氢氧化铷是弱碱 |
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
 .
. ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.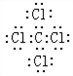 ,该化合物是由极性(填“极性”或“非极性”)键形成的.
,该化合物是由极性(填“极性”或“非极性”)键形成的. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ④⑤⑥ | C. | ②⑤⑥ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由分子组成的物质中一定存在共价键 | |
| B. | 由非金属元素组成的化合物一定是共价化合物 | |
| C. | 非极性键只存在双原子分子中 | |
| D. | 两个非金属元素原子间不可能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
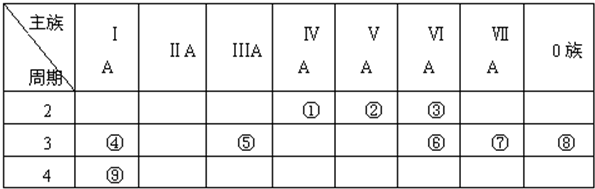
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY2 | B. | X2Y3 | C. | X2Y | D. | XY |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com