
【题目】H2和CO合成甲醇反应为:CO(g)+2H2(g)![]() CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2molCO和1molH2,10min后达到平衡,测得含有0.4molCH3OH(g)。则达到平衡时CO的浓度为___;10min内用H2表示的化学反应速率为___;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有___(填一种合理的措施)。
CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2molCO和1molH2,10min后达到平衡,测得含有0.4molCH3OH(g)。则达到平衡时CO的浓度为___;10min内用H2表示的化学反应速率为___;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有___(填一种合理的措施)。
【答案】0.4mol/L 0.04mol/(L·min) 增大压强(或增加H2的量)
【解析】
根据三段式分析解答达到平衡时CO的浓度和10min内用H2表示的化学反应速率;由于该反应是体积减小的反应,根据影响平衡移动和化学反应速率的因素分析判断加快CH3OH的生成速率并提高CO的转化率的方法。
CO(g)+2H2(g)CH3OH(g)(正反应是放热反应)
开始量(mol):1.21 0
转化量(mol):0.40.8 0.4
平衡量(mol):0.80.2 0.4
达到平衡时CO的浓度为![]() =0.4mol/L,10min内用H2的浓度变化量△c(H2)=
=0.4mol/L,10min内用H2的浓度变化量△c(H2)=![]() =0.4mol/L,10min内用H2表示的平均反应速率v=
=0.4mol/L,10min内用H2表示的平均反应速率v=![]() =0.04mol/(L·min);由于该反应是气体体积减小的放热反应,因此可以通过增大压强或充入氢气的方法提高CH3OH的生成速率,并提高CO的转化率,故答案为:0.4mol/L;0.04mol/(L·min);增大压强(或增加H2的量)。
=0.04mol/(L·min);由于该反应是气体体积减小的放热反应,因此可以通过增大压强或充入氢气的方法提高CH3OH的生成速率,并提高CO的转化率,故答案为:0.4mol/L;0.04mol/(L·min);增大压强(或增加H2的量)。


科目:高中化学 来源: 题型:
【题目】金属钠晶体为体心立方晶胞,实验测得钠的密度为ρ(g·cm-3)。已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定金属钠原子为等径的刚性小球且处于体对角线上的三个球相切。则钠原子的半径r(cm)为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]太阳能电池板材料除单品硅外,还有含铜、铟、镓、硒等元素的化学物质。
(1)基态硅原子的价电子轨道表达式__________。
(2)有一类组成最简单的有机硅化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似。硅烷中硅采取________杂化方式,硅烷的沸点与相对分子质量的关系如下图所示现这种变化的原因是_________。

(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为____________(用元素符号表示)。
(4)气态SeO3分子的立体构型为_________,与SeO3互为等电子体的一种阴离子为_______(填化学式)。
(5)CuCl的盐酸溶液吸收CO形成氯化羰基亚铜[CuCl(CO)2 H2O,通常形成二聚体,结构示意图如下。则该化合物中与Cu+形成配位键的原子是_________。

(6)—种铜金合金晶体具有面心立方最密堆枳结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中铜原子(Cu)与金原子(Au)个数比为____________,若该晶体的晶胞棱长为a nm,则该合金密度为____________(列出计算式,不要求计算结果,阿伏加徳罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
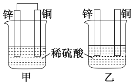
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的c(H+)均减小
D.产生气泡的速率甲比乙慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的有机化工原料,可由乙醇脱水制备。涉及反应如下:
①2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
②2CH3OH(g)![]() C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
③CH3CH2OH(g)![]() CH3OCH3(g) △H3= +50.7kJmol-1
CH3OCH3(g) △H3= +50.7kJmol-1
④C2H5OH(g)![]() C2H4(g)+ H2O(g) △H4=akJmol-1
C2H4(g)+ H2O(g) △H4=akJmol-1
回答下列问题:
(1)a=___________。
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①欲提高C2H5OH的平衡转化率,应采取的措施为___________(填字母)。
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为_________,平衡时C2H5OH的转化率为_______(结果保留两位有效数字,下同),该反应的平衡常数K=_________。
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=_____mol,n(C2H5OH)=_____mol。
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是______,由此规律推出反应在12h时c(C2H5OH)等于______molL-1
反应时间t/h | 0 | 4 | 8 | 16 |
c(C2H5OH)/(molL-1) | 0.10 | 0.051 | 0.026 | 0.0065 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列“实际应用”对应“化学知识原理”说法错误的是( )
选项 | 实际应用 | 化学知识原理 |
A | 泡沫灭火器中装有碳酸氢钠溶液 和硫酸铝溶液 | 碳酸氢钠溶液和硫酸铝溶液水解且相互促进 |
B | 工业上采用高压(20-50MPa)合成NH3 | 应用勒夏特列原理 |
C | 施加石膏降低盐碱地(含Na2CO3)的碱性 | CaCO3溶度积小于CaSO4 |
D | 选用金属锂做电池电极材料 | 锂轻且在空气中稳定 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 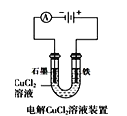 中阳极处能产生使湿润淀粉KI试纸变蓝的气体
中阳极处能产生使湿润淀粉KI试纸变蓝的气体
B. 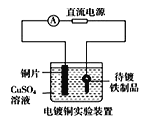 中待镀铁制品应与电源正极相连
中待镀铁制品应与电源正极相连
C. 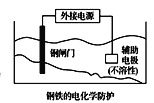 中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
D. 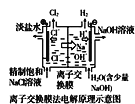 中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1000mol/L的盐酸滴定20 mL0.1000mol/L氨水,滴定曲线如下图,下列说法正确的是( )
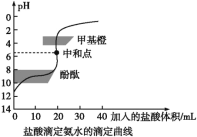
A. 该中和滴定适宜用酚酞作指示剂
B. 两者恰好中和时,溶液的pH=7
C. 达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D. 当滴入盐酸达40 mL时,溶液中c(NH4+)+c(H+)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯是一种食用香料,其结构简式如图所示。下列有关柠檬烯的分析正确的是( )
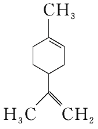
A. 它的一氯代物有6种
B. 它的分子中所有的碳原子一定在同一平面上
C. 它和丁基苯![]() 互为同分异构体
互为同分异构体
D. 一定条件下,它分别可以发生加成、取代、氧化、还原等反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com