
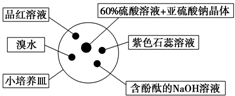
 如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )| A. | 紫色石蕊溶液变蓝色 | B. | 品红溶液褪色 | ||
| C. | 溴水橙色褪去 | D. | 含酚酞的NaOH溶液红色变浅或褪色 |
分析 二氧化硫为酸性氧化物,能够与水反应生成亚硫酸,亚硫酸电离产生氢离子,溶液显酸性,二氧化硫能够与氢氧化钠反应生成亚硫酸钠和水,具有漂白性,能够使品红溶液褪色,具有还原性能够与溴水反应使溴水褪色,据此解答.
解答 解:A.二氧化硫为酸性氧化物,能够与水反应生成亚硫酸,亚硫酸电离产生氢离子,溶液显酸性,遇到紫色石蕊溶液变红,故A错误;
B.二氧化硫具有漂白性,能够使品红溶液褪色,故B正确;
C.二氧化硫具有还原性能够与溴水反应使溴水褪色,故C正确;
D.二氧化硫为酸性氧化物,能够与氢氧化钠反应生成亚硫酸钠和水,使含酚酞的NaOH溶液红色变浅或褪色,故D正确;
故选:A.
点评 本题考查了元素化合物知识,熟悉二氧化硫酸性氧化物的性质、漂白性、还原性是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X:3s23p1 Y:3s23p5 | B. | X:2s22p3 Y:2s22p4 | ||
| C. | X:3s23p1 Y:2s22p4 | D. | X:3s2 Y:2s22p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 相对分子质量 | 密度(g/mL) | 沸点(℃) | 水中 溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:CO2>KCl>SiO2 | B. | 水溶性:HCl>H2S>SO2 | ||
| C. | 沸点:CH3OCH3>CH3CH2OH | D. | 热稳定性:HF>H2O>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “两水”都是混合物,溶液中含有的粒子种类、数目相同 | |
| B. | “两水”中存在相同弱电解质的电离 | |
| C. | “两水”都有刺激性气味,都能漂白有机色素 | |
| D. | “两水”放置时间较久后,都会因为相同的原理而变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 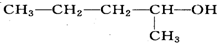 的名称是1-甲基-1-丁醇 的名称是1-甲基-1-丁醇 | |
| B. | 食醋中含有乙酸,乙酸可由乙醇或乙醛氧化得到 | |
| C. | 1mol 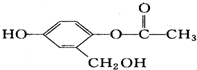 最多能与4molNaOH溶液反应 最多能与4molNaOH溶液反应 | |
| D. | 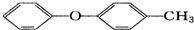 的同分异构体中有醇、酚、脂等类别 的同分异构体中有醇、酚、脂等类别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
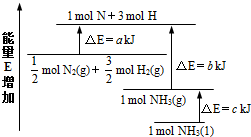 氨气是氮循环中的重要物质,在人类的生产生活中有着广泛的应用.
氨气是氮循环中的重要物质,在人类的生产生活中有着广泛的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com