
【题目】25℃时,用相同浓度的NaOH溶液,分别滴定20mL0.1mol·L-1的三种酸(HA、HB和HD)溶液体积的变化曲线如图所示。下列判断正确的是( )
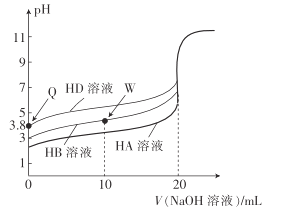
A.由Q点可知,HD的电离平衡常数Ka≈10-7.6
B.三种酸的酸性强弱:HD>HB>HA
C.滴定至W点时,溶液中存在:c(B-)>c(Na+)>c(H+)>c(OH-)
D.当三种溶液恰好完全中和后将其混合,溶液中存在:c(Na+)=c(A-)+c(B-)+c(D-)
【答案】C
【解析】
A.Q点溶液的pH=3.8,c(D-)≈c(H+)=10-3.8mol·L-1,c(HD)≈0.1mol·L-1,则HD的电离平衡常数![]() ,A错误;
,A错误;
B.根据图象可知,没有加碱时,0.1mol·L-1的三种酸(HA、HB和HD)溶液,pH大小为:HD>HB>HA,溶液pH越大酸性越弱,则三种酸的酸性强弱:HD<HB<HA,B错误;
C.W点时,加入的NaOH反应掉一半的HB,则此时溶质为等浓度的HB、NaB,HB电离出H+,B-水解产生OH-,结合图示,可知溶液的pH<7,溶液呈酸性,则c(H+)>c(OH-),,说明HB的电离程度大于B-的水解程度,则c(B-)>c(HB)。结合物料守恒c(B-)+c(HB)=2c(Na+),可知:c(B-)>c(Na+)>c(HB),溶液中离子浓度大小为:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),C正确;
D.0.1mol·L-1的三种酸的pH都大于>1,说明三种酸都是弱酸,则完全反应后生成的都是强碱弱酸盐,混合液呈碱性,则c(H+)<c(OH-),结合电荷守恒c(Na+)+c(H+)=c(A-)+c(B-)+c(D-)+c(OH-),可知:c(Na+)>c(A-)+c(B-)+c(D-),D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】有机物Z常用于治疗心律失常,Z可由有机物X和Y在一定条件下反应制得,下列叙述正确的是
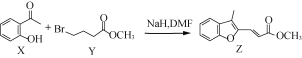
A.X中所有原子可能在同一平面内
B.X、Z均能与酸性KMnO4溶液反应
C.1 mol Y最多能与2 mol NaOH反应
D.室温下Z与足量Br2加成产物的分子中有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中,各分子的空间构型、中心原子的杂化方式以及孤电子对数均正确的是
选项 | 分子 | 空间构型 | 杂化方式 | 孤电子对数 |
A | NH3 | 平面三角形 | sp3杂化 | N含有一对孤电子对 |
B | CCl4 | 正四面体 | sp3杂化 | C不含有孤电子对 |
C | H2O | V形 | sp2杂化 | O含有两对孤电子对 |
D | CO32- | 三角锥形 | sp3杂化 | C含有一对孤电子对 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g) △H1=-270kJmol-1。下列说法不正确的是( )
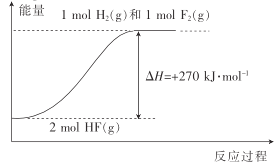
A.1molH2(g)与1molF2(g)的键能之和比2molHF(g)的键能高270kJ·mol-1
B.HF(g)分解为H2(g)与F2(g)的反应过程的能量变化可用如图来表示
C.若反应中有20gHF(g)生成,则放出135kJ热量
D.若H2(g)+Cl2(g)=2HCl(g) △H2=-QkJ·mol-1,则Q<270
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示,下列有关说法不正确的是( )
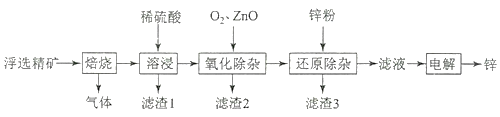
A.滤渣1的成分是SiO2 , 滤渣2的成分是Fe(OH)3
B.焙烧过程中主要反应的化学方程式为2ZnS+3O2![]() 2ZnO+2SO2
2ZnO+2SO2
C.溶液中的Cd2+可用锌粉除去,反应的离子方程式为Zn+Cd2+=Zn2++Cd
D.若不通入氧气,其后果是无法除去杂质Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用所学知识,解决下列问题。
(1)AlCl3溶液呈___(填“酸”“中”或“碱”)性,原因是___(用离子方程式表示)。实验室配制AlCl3溶液时,常将AlCl3固体先溶于较浓的盐酸中,再用蒸熘水稀释到所需的浓度,目的是___。
(2)今有常温下五种溶液:CH3COONa溶液、NH4Cl溶液、NaOH溶液、氨水、NH4HSO4溶液。
①CH3COONa溶液pH___(填“>”“=”或“<” )7,若要使溶液的pH增大,可采取的措施是___。
②pH相等的NaOH溶液和CH3COONa溶液,分别稀释相同倍数后,NaOH溶液的pH___(填“>”“=”“<”)CH3COONa溶液。
③物质的量浓度均为0.1mol·L-1的三种溶液:A.NH4Cl溶液 B.NH4HSO4溶液 C.氨水,c(NH4+)由大到小的顺序为___(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物F(![]() )是有机合成的中间体。现以甲苯为原料合成F的路线如图所示。
)是有机合成的中间体。现以甲苯为原料合成F的路线如图所示。

已知:①R-CN![]() R-COOH
R-COOH
②
回答下列问题:
(1)A→B的反应试剂是___。
(2)B→C反应的化学方程式为___,反应类型是___。D→E的反应类型是___。
(3)D中含氧官能团的名称是___。
(4)G是F的同系物,比F多一个碳原子,其苯环上含两个取代基的同分异构体有___种(不考虑立体异构)。其中核磁共振氢谱有六组峰,且峰面积之比为1:1:1:2:2:3的有机物结构简式为___。
(5)结合以上合成路线及相关信息,设计由苯合成苯酚的合成路线___。(用合成流程图表示,并注明反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式如图,下列对该物质的叙述中正确的是

A.该有机物能发生取代反应、氧化反应和消去反应
B.1mol该有机物最多可与2molNaOH发生反应
C.该有机物可以与溴的四氯化碳溶液发生加成反应使之褪色
D.该有机物有3个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂,实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1。
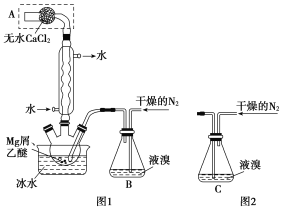
主要步骤如下:
步骤1:三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2:缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3:反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4:常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性
②MgBr2+3C2H5OC2H5→MgBr2·3C2H5OC2H5
请回答下列问题:
(1)仪器A的名称是__。实验中不能用干燥空气代替干燥N2,原因是__。
(2)如将装置B改为装置C(图2),可能会导致的后果是__。
(3)有关步骤4的说法,正确的是__。
A.可用95%的乙醇代替苯溶解粗品
B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯
D.该步骤的目的是除去乙醚和可能残留的溴
(4)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4-=Mg+Y2-
①滴定前润洗滴定管的操作方法是__。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是__(以质量分数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com