
【题目】聚对苯二甲酸二烯丙酯(PDAP)是一种优良的热固性树脂,这种材料可以采取下列路线合成:

已知:

(1)F的分子式是________;C的化学名称是_________。
(2)反应④的类型是________;反应条件是________。
(3)写出反应③的化学方程式________________。
(4)D的结构简式是________。
(5)G是E的同分异构体,G具有如下性质:①能发生银镜反应,且1 mol G与银氨溶液反应时最多可得到4 mol Ag;②遇FeCl3溶液呈紫色;③在稀硫酸中能发生水解反应。则符合上述条件的G最多有________种,这些不同结构的物质,它们的核磁共振氢谱峰的数目有何特点?__________________。
(5)试仿照题目中合成流程图的形式,完成![]() 这一合成流程_______________________。
这一合成流程_______________________。
【答案】 C14H14O4 丙烯醇 取代反应 浓硫酸、加热 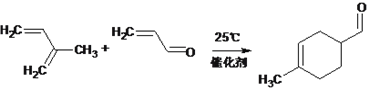
 10 各物质的核磁共振氢谱峰的数目相同,均为6种
10 各物质的核磁共振氢谱峰的数目相同,均为6种 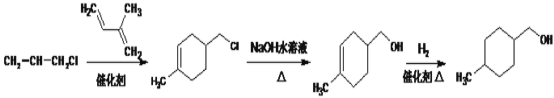
【解析】考查有机物的推断与合成,(1)根据PDAP的结构简式,反应⑤为加聚反应,即F的结构简式为 ,即F的分子式为C14H14O4,C3H6的结构简式为CH2=CHCH3,反应①发生取代反应,即B的结构简式为CH2=CHCH2Cl,反应②发生水解反应,即C的结构简式为CH2=CHCH2OH,C的名称为丙烯醇;(2)根据F的结构简式,以及C的结构简式,推出E的结构简式为
,即F的分子式为C14H14O4,C3H6的结构简式为CH2=CHCH3,反应①发生取代反应,即B的结构简式为CH2=CHCH2Cl,反应②发生水解反应,即C的结构简式为CH2=CHCH2OH,C的名称为丙烯醇;(2)根据F的结构简式,以及C的结构简式,推出E的结构简式为 ,则反应④的类型为取代或酯化反应;酯化反应的条件是浓硫酸和加热;(3)根据信息II,以及反应③的产物,C5H8为异戊二烯,则化学反应方程式为
,则反应④的类型为取代或酯化反应;酯化反应的条件是浓硫酸和加热;(3)根据信息II,以及反应③的产物,C5H8为异戊二烯,则化学反应方程式为 ;(4)根据E的结构简式,以及信息I,则D的结构简式为
;(4)根据E的结构简式,以及信息I,则D的结构简式为 ;(5)①能发生银镜反应,说明含有醛基,1molG与银氨溶液反应最多生成4molAg,说明1molG中含有2mol醛基;遇FeCl3溶液呈紫色,说明含有酚羟基;能发生水解,说明含有甲酸某酯的结构,因此结构简式为
;(5)①能发生银镜反应,说明含有醛基,1molG与银氨溶液反应最多生成4molAg,说明1molG中含有2mol醛基;遇FeCl3溶液呈紫色,说明含有酚羟基;能发生水解,说明含有甲酸某酯的结构,因此结构简式为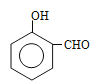 (-OOCH在苯环上的位置有4种)、
(-OOCH在苯环上的位置有4种)、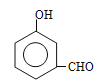 (-OOCH在苯环上的位置有4种)、
(-OOCH在苯环上的位置有4种)、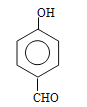 (-OOCH在苯环上的位置有2种),共有10种,根据结构简式,得出各物质的核磁共振氢谱峰的数目相同,均为6种;(5)根据信息,以及上述合成路线,推出生成目标产物的路线为
(-OOCH在苯环上的位置有2种),共有10种,根据结构简式,得出各物质的核磁共振氢谱峰的数目相同,均为6种;(5)根据信息,以及上述合成路线,推出生成目标产物的路线为 。
。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列说法正确的是( )
A.4 g氦气中含有的分子数和原子数均为NA
B.标准状况下,22.4 L CCl4中含有的分子数为NA
C.1 L 0.1 molL﹣1乙醇溶液中含有的氧原子数为0.1NA
D.1 mol Cl2完全反应转移的电子数一定是2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示,则下列有关说法中不正确的是( ) 
A.能发生加成、取代、氧化反应
B.1 mol该物质最多可与7mol NaOH反应
C.1 mol该物质最多可与6 mol H2反应
D.能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下描述
①冰的密度小于水,液态水中含有(H2O)n都是由于氢键所致
②不同种元素组成的多原子分子里的键一定都是极性键
③离子键就是阳离子、阴离子的相互引力
④用电子式表示MgCl2的形成过程:![]()
⑤H2分子和Cl2分子的反应过程就是H2、Cl2分子里的共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成离子键的过程
上述说法正确的是( )
A. ①②③④⑤ B. ①② C. ④ D. ①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列生活中常见物质的俗名与化学式相对应的是
A.纯碱— NaOHB.漂白粉— NaClO
C.大理石— CaCO3D.烧碱— Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。下列有关说法正确的是

A. 关闭 K2,打开 K1,滴加硫酸,则装置 B 中每消耗 1molNa2O2,转移电子数为NA
B. 关闭 K1,打开 K2,试剂 X 是酸性 KMnO4 或 FeCl3 溶液,均可证明 SO2 有还原性
C. 为防止环境污染,装置C和E中的试剂均取用饱和的石灰水
D. 实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含0.02mol CO2和0.01 mol CO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加_____g。
(2)已知:2CO(g)+O2(g)==2CO2(g) △H=-566.0kJ/mol,键能Eo-o=499.0kJ/mol。则反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=_________kJ/mol。
CO2(g)+O(g)的△H=_________kJ/mol。
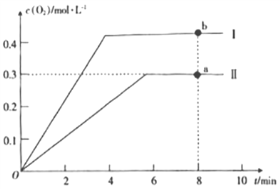
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图所示。

①恒温恒容条件下,能表示该可逆反应达到平衡状态的有___(填字母)。
A.CO的体积分数保持不变 B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO的浓度等于生成CO2的浓度
②分析上图,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=___(计算结果保留1位小数)。
③向2L的恒容密闭容器中充入2molCO2(g),发生反应: 2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后,c(O2)随时间的变化,则改变的条件是____;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后,c(O2)随时间的变化,则改变的条件是____;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)____(填“>”“<”或“=”)vb(CO)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com