
| A. | 0.595g | B. | 1.42g | C. | 2.485g | D. | 2.72g |
分析 2.8g铁粉的物质的量为:$\frac{2.8g}{56g/mol}$=0.05mol,1.008L(标准状况)的物质的量为:$\frac{1.008L}{22.4L/mol}$=0.045mol,如果0.045mol全部是二氧化氮固体剩余物转移电子数为0.045mol,若0.045mol全部是一氧化氮固体剩余物转移电子数为0.135mol,根据得失电子守恒,分析解答.
解答 解:2.8g铁粉的物质的量为$\frac{2.8g}{56g/mol}$=0.05mol,1.008L(标准状况)的物质的量为:$\frac{1.008L}{22.4L/mol}$=0.045mol,如果0.045mol全部是二氧化氮固体剩余物转移电子数为0.045mol,若0.045mol全部是一氧化氮固体剩余物转移电子数为0.135mol,设生成的四氧化三铁的物质的量为xmol,则固体剩余物中未参加反应的铁的物质的量为(0.05-3x)mol,所以与硝酸反应提供电子的物质的量为:[(0.05-3x)×3+x]mol,根据得失电子守恒得0.045<(0.05-3x)×3+x<0.135,所以0.001875<x<0.013125,则0.010625<0.05-3x<0.044375,铁的质量取值范围为0.010625×56<m<0.044375×56,也就是0.595g<m<2.485g,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及电子守恒、原子守恒的计算为解答的关键,侧重分析能力与计算能力的综合考查,题目难度中等.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
将106 g的Na2CO3和84 g NaHCO3先经充分强热后,再分别跟足量的盐酸反应,下列说法错误的是( )
A.消耗盐酸一样多 B.放出CO2的总量一样多
C.后者生成的NaCl是前者的一半 D.后者消耗盐酸是前者的一半
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
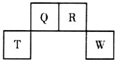 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的原子核内质子数与核外最外层电子数之比为8:3.下列说法正确的是( )| A. | Q与W的原子能形成非极性分子 | |
| B. | T的离子半径大于W的离子半径 | |
| C. | RHn在同族元素的气态氢化物中沸点最低 | |
| D. | 在R的最高价氧化物对应水化物的浓溶液中单质T不溶解,说明未发生化学反应 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:实验题
高纯氧化锌广泛应用于电子工业,某研究小组设计如下流程制备高纯氧化锌。
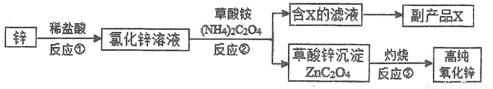
(1)反应①的化学方程式为___________________。
(2)反应②的基本反应类型是_____________。
(3)副产品X的化学式为:______________。从含X的滤液中获取固体X的实验操作步骤是:___________、____________、过滤。
(4)反应③属于分解反应,除得到氧化锌外还生成2种常见气体,其化学式为_________、________。
(5)若用纯度为97.5%的1kg粗锌制备高纯氧化锌,理论上最多可生产出氧化锌的物质的量为:_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “千淘万漉”的基本原理是化学中的萃取 | |
| B. | 24K金(纯金)的各方面物理性能都比18K金优越 | |
| C. | 在铜件外镀金,金镀层破损了,会加快铜件的腐蚀速率 | |
| D. | 常温下,金不易被氧化,不与其它任何物质发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:W<Z | |
| B. | 气态氢化物的稳定性:W>Z | |
| C. | 简单离子半径:Z>W>X>Y | |
| D. | X的氢化物中不可能含有非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应从电子转移角度看,与SO2+H2O═H2SO3是同一反应类型 | |
| B. | 该反应从电子转移角度看,每生成6mol铜,转移电子12mol | |
| C. | 该反应中,Cu2S既是还原剂又是氧化剂 | |
| D. | 该反应中,氧元素氧化了硫元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车催化转化器中尾气处理反应的化学方程式为CO+NO$\frac{\underline{\;\;△\;\;}}{\;}$C+NO2 | |
| B. | 铁红溶于足量氢碘酸的离子方程式为Fe2O3+6H+═2Fe3++3H2O | |
| C. | 加入铝粉能产生氢气的溶液中可能存在大量的:K+、Ba2+、AlO2-、Cl- | |
| D. | pH=0的溶液中可能存在大量的:Na+、Fe2+、SO42-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-、CH3CHO可以大量共存 | |
| C. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 | |
| D. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com