
| A、标准状况下11.2LHCl |
| B、6.02×1023个CO2 |
| C、36gH2O(H2O的摩尔质量为18g?mol-1) |
| D、1.5molN2 |
| V |
| Vm |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可燃性气体点燃前应检验其纯度 |
| B、实验剩余药品不能放回原试剂瓶 |
| C、气体实验前进行装置气密性检查 |
| D、用托盘天平称量时应保证“左物右码” |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
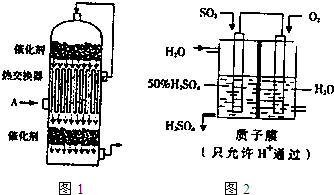
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com