
| A. | ①=②=③ | B. | ①>②>③ | C. | ①=②>③ | D. | ①=②<③ |
分析 设烧瓶容积均为V,氨气、HCl极易溶于水,水可充满烧瓶,NO2气体与水发生3NO2+H2O=2HNO3+NO,水不能充满,结合c=$\frac{n}{V}$计算.
解答 解:设烧瓶容积均为V,氨气、HCl极易溶于水,水可充满烧瓶,NO2气体与水发生3NO2+H2O=2HNO3+NO,水不能充满,
①、②中浓度均为$\frac{\frac{V}{22.4}mol}{VL}$=$\frac{1}{22.4}$mol/L,
③中溶质为硝酸,其浓度为$\frac{\frac{\frac{2}{3}V}{22.4}mol}{\frac{2}{3}VL}$=$\frac{1}{22.4}$mol/L,
故选A.
点评 本题考查物质的量浓度的计算,为高频考点,把握溶液体积的判断、物质的量与浓度的关系为解答的关键,侧重分析与计算能力的考查,注意二氧化氮与水反应生成硝酸,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.6 | B. | 0.333 | C. | 0.4 | D. | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取l.06g无水碳酸钠,在烧杯中加适量水溶解,待冷却到室温后,将溶液转移到容量瓶中 | |
| B. | 定容时,若仰视,则所配溶液的浓度将偏高 | |
| C. | 定容时,若加水超过刻度线,可用胶头滴管小心吸出多余部分 | |
| D. | 在使用容避瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O和S4O62-都是还原产物 | |
| B. | 1mol Fe2+参加反应时,转移2mol电子 | |
| C. | Fe2+、S2O32-都是还原剂 | |
| D. | x=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| B. | 1mol/L FeCl3溶液中,阴、阳离子总数大于0.4NA | |
| C. | 12g金刚石中所含的C-C键数为2NA | |
| D. | 18g的D2O与NA个CH3-具有相同的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸雕刻玻璃:Si+4HF═SiF4↑+2H2↑ | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
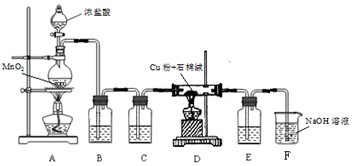
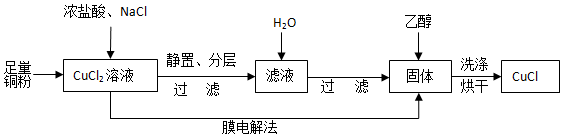
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com