
【题目】下列物质的杂化方式不是sp3杂化的是( )
A. CO2B. CH4C. NH3D. H2O
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】常温下,向10.00 mL 0.1mol/L某二元酸H2X溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化如图所示(忽略温度变化),已知:常温下,H2X的电离常数Ka1=1.1×10-5,Ka2=1.3×10-8。下列叙述正确的是
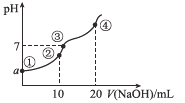
A.a近似等于3
B.点②处c(Na+)+2c(H+)+c(H2X)=2c(X2-)+c(HX-)+2c(OH-)
C.点③处为H2X和NaOH中和反应的滴定终点
D.点④处c(Na+)=2c(X2-)>c(OH-)>c(HX-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示。下列说法正确的是
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示。下列说法正确的是
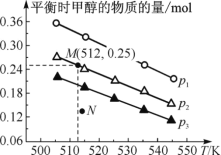
A. 该反应的正反应为放热反应
B. 压强大小关系:p1<p2<p3
C. M点对应的平衡常数K的值约为 1.04×10-2
D. 在p2及512 K时,图中N点v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组的同学用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定。回答下列问题:
(1)用分析天平准确称取该样品5.0 g,全部溶于水配制成1 000.0 mL的溶液。用____(填仪器名称)量取20.00 mL放在锥形瓶中,滴加几滴酚酞,待测。该中和滴定中滴定终点的现象是___。
(2)用0.10 mol·L-1稀盐酸滴定未知浓度的NaOH溶液,实验数据如下表所示:
实验编号 | 待测NaOH溶液的体积/mL | 稀盐酸的体积/mL |
1 | 20.00 | 24.01 |
2 | 20.00 | 23.99 |
3 | 20.00 | 22.10 |
计算样品中NaOH的质量分数为______。
(3)若滴定前,滴定管尖端有气泡,滴定终了气泡消失,将使所测结果____ (填“偏高”、“偏低”或“不变”,下同);若滴定过程中不慎将锥形瓶中溶液洒出,会使所测结果_____;若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PBAT(聚已二酸对苯二甲酸丁酯)可被微生物几乎完全降解,成为包装、医疗和农用薄膜等领域的新兴材料,它可由聚合物PBA和PBT共聚制得,一种合成路线如下:

已知: 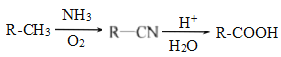
![]()
回答下列问题:
(1)G的官能团的名称为________。
(2)①的反应类型为___________;反应②所需的试剂和条件是___________。
(3)D的结构简式为___________;H的化学名称为___________。
(4)⑤的化学方程式为_______________________________________________。
(5)M与G互为同系物,M的相对分子质量比G大14;N是M的同分异构体,写出同时满足以下条件的N的结构简式:___________________(写两种,不考虑立体异构)。
Ⅰ、既能与FeCl3发生显色反应,又能发生水解反应和银镜反应;
Ⅱ、与NaOH溶液反应时,1mol N能消耗4molNaOH;
Ⅲ、核磁共振氢谱有五组峰,峰面积比为1:2:2:2:1。
(6)设计由丙烯为起始原料制备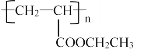 的单体的合成路线(其它试剂可任选)________________________________________________________________。
的单体的合成路线(其它试剂可任选)________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据热化学方程式N2(g)+3H2(g)2NH3(g)+92kJ,下列有关图象和叙述中正确的是
A.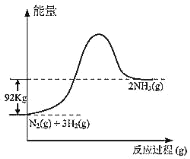
B.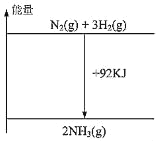
C.向密闭容器中通入1mol氮气和3mol氢气发生反应放出92kJ的热量
D.形成1mol氮氮键和3mol氢氢键所放出的能量比拆开2mol氮氢键所吸收的能量多92kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:浅绿色的FeSO4·7H2O加热失水为FeSO4·H2O时呈白色,成FeSO4时为无色固体。FeSO4经加热可分解为FeO和SO3,经强热可分解为Fe2O3、SO3和SO2。SO3的熔点为16.8℃,沸点为44.8℃。化学兴趣小组对上述资料进行实验探究。
第一步:用绿矾制无水硫酸亚铁。
(1)把药品装在仪器(写名称)____中进行加热,已将结晶水除净的依据是(选填序号)___。
A.观察无水蒸汽产生 B.经恒重操作最后两次称量所得到的质量完全相同
C.晶体完全变为无色 D.经恒重操作最后两次质量差不超过天平感量误差
第二步:取一定量无水硫酸亚铁置于如图(部分夹持仪器略去)所示A的试管中进行加热。
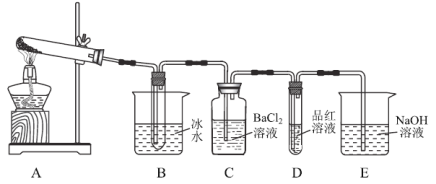
(2)实验过程中C、D、E中除有少许气泡外无其它明显现象。若将B试管中产生的少量固体溶于水,检验该溶液中的阴离子的方法是:___。实验过程中还有一处明显的现象是:________________。
第三步:将第二步实验的装置中A、B部分改为如图所示的![]() 、
、![]() ,C,D,E不变(C,E中都装有足量溶液)。
,C,D,E不变(C,E中都装有足量溶液)。
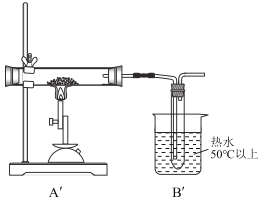
同样取一定量无水硫酸亚铁置于![]() 的石英玻璃管中进行加热,反应完毕后,从石英玻璃仪器中滞留气体排尽。观察到C中产生白色沉淀,D试管中溶液褪色。
的石英玻璃管中进行加热,反应完毕后,从石英玻璃仪器中滞留气体排尽。观察到C中产生白色沉淀,D试管中溶液褪色。
(3)实验中![]() 的玻璃管中的现象是:______,说出
的玻璃管中的现象是:______,说出![]() 装置的一个作用是:________。
装置的一个作用是:________。
最后将C中液体完全取出进行过滤、洗涤、干燥。称得所得固体质量为23.300g,所得溶液加水稀释定容为1L,取出20.00mL置于锥形瓶中,用已知浓度的标准NaOH溶液测定该1L溶液中一种溶质的浓度。
(4)上述实验过程中用到的定量仪器有_______,用到的指示剂是_______。
(5)将所得溶液加水定容时,加水所用的仪器名称为_____,若去称量![]() 玻璃管中残留固体的质量应接近于____g。
玻璃管中残留固体的质量应接近于____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于相邻两个周期的主族元素A、B、C、D,它们的原子半径依次变小;A离子和B离子的电子层相差两层,且能形成BA2型的离子化合物;C的离子带3个正电荷且核外电子排布与氖相同;D气态氢化物的分子式为H2D,D在它的最高价氧化物中的质量分数是40%且D原子核中有16个中子。
试回答:
(1)按要求填空:
A元素的名称______________;B元素的符号____________;
C原子的外围电子排布式为____________;D的原子结构示意图____________;
(2)B、C、D的第一电离能由大到小的顺序是:______________(填元素符号);
(3)A、B、C的电负性由大到小的顺序是:____________(填元素符号);
(4)A与B形成的化合物的电子式__________________;
(5)将C投入到的KOH溶液中现象为______________,相应的离子反应方程式为________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮的循环和转化对生产、生活有重要的价值。
I.(1)写出实验室制备氨气的化学方程式________ 。
II.氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如下图所示。
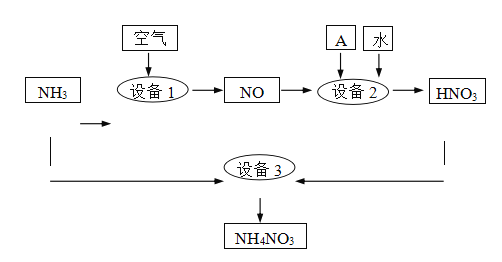
(2)设备1、3中发生反应的化学方程式分别是______、 ________ 。设备2中通入的物质A是________。
III.氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以NH4+和NH3H2O的形式存在。某工厂处理氨氮废水的流程如下:
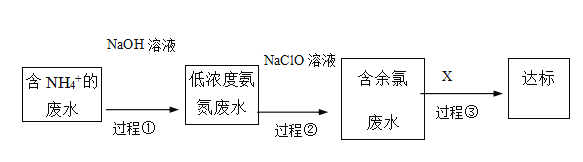
(3)过程①的目的是将NH4+转化为NH3,并通过鼓入大量空气将氨气吹出,写出NH4+转化为NH3的离子方程式________ 。
(4)过程②加入NaClO溶液可将氨氮转化为无毒物质,反应后含氮元素、氯元素的物质化学式分别为___、_______。
(5)含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到去除余氯的目的(填序号)_________。
a.KOH b.Na2SO3 c.KMnO4 D.NaCl
写出其中一个反应的离子方程式__________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com