
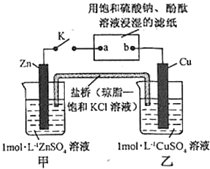
| A. | Cu 电极上发生还原反应 | B. | 电子沿 Zn→a→b→Cu 路径流动 | ||
| C. | 片刻后甲池中 c(SO42-)增大 | D. | 片刻后可观察到滤纸 b 点变红色 |
分析 甲、乙装置能自发的进行氧化还原反应,所以是原电池,锌易失电子作负极,铜作正极,则含有硫酸钠溶液的滤纸是电解池,a是阴极,b是阳极,阴极上氢离子放电,阳极上氢氧根离子放电,电子从负极沿导线流向电解池阴极,原电池放电时,阴离子向负极移动,阳离子向正极移动.
解答 解:甲、乙装置能自发的进行氧化还原反应,所以是原电池,锌易失电子作负极,铜作正极,则含有硫酸钠溶液的滤纸是电解池,a是阴极,b是阳极,
A、铜电极上铜离子得电子发生还原反应而生成铜,故A正确;
B、电子从Zn→a,b→Cu路径流动,电子不进入电解质溶液,故B错误;
C、锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,硫酸根离子不参加反应,所以硫酸根离子浓度不变,故C错误;
D、电解池中,a电极上氢离子放电生成氢气,同时a电极附近生成氢氧根离子,导致溶液碱性增强,所以a极变红色,故D错误;
故选A.
点评 本题考查了原电池和电解池原理,明确各个电极上发生的电极反应是解本题关键,易错选项是B,注意电子不进入电解质溶液,电解质溶液是通过阴阳离子的定向移动形成电流,为易错点.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个N≡N键断裂的同时,有1个H-H键形成 | |
| B. | 1个N≡N键断裂的同时,有3个H-H键断裂 | |
| C. | 1个N≡N键断裂的同时,有6个N-H键断裂 | |
| D. | 1个N≡N键断裂的同时,有6个H-H键形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非极性分子中的原子一定无孤电子对 | |
| B. | 平面三角型分子一定是非极性分子 | |
| C. | 二氯甲烷(CH2Cl2)分子的中心原子是SP3杂化,键角均为109°28′ | |
| D. | ABn型分子的中心原子最外层满足8电子结构,则ABn不一定是非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | B. | 第一电离能:Na<Mg<Al | ||
| C. | 电负性:Na<Mg<Al | D. | 还原性:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3g钠与水反应失去的电子数目为0.2NA | |
| B. | 20℃、101KPa时,5.6L NH3 所含的原子数目为NA | |
| C. | 10℃、101KPa时,16g CH4 所含有的电子数为10NA | |
| D. | 1mol NaCl固体溶于1L水所得的溶液中NaCl的物质的量浓度为1 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com