
【题目】分析城市空气样本,主要污染物为可吸入颗粒物pm2.5、NOx、SO2等,其主要来源为燃煤和机动车尾气排放等.
(1)某同学为检测样本中所含成份,将样本用蒸馏水处理制成待测试样,设计实验及实验现象如图:
①该实验能确认存在的阳离子是 .
②该实验检测出样本中有NO3﹣ , 根据是(用化学方程式解释) .
③根据该实验能否确定样本中含有SO32﹣ , (填“能”或“否”),若要确定SO32﹣ , 所需的实验药品可以是 .
(2)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物.下列说法不正确的是(填字母序号).
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(3)科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2 . 
①CaSO4可以调节水泥的硬化时间.尾气中SO2与石灰乳反应生成CaSO4的化学方程式为 .
②Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等.尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式 .
【答案】
(1)Na+、NH4+、K+;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2;否;酸性高锰酸钾溶液
(2)bc
(3)2SO2+O2+2Ca(OH)2═2CaSO4+2H2O;NO+NO2+Ca(OH)2═Ca(NO2)2+H2O
【解析】解:(1)①物质焰色反应为黄色,所以含有钠离子,和强碱共热反应产生氨气,能使石蕊试纸变蓝,证明含有铵根离子,加入硝酸酸化的硝酸银会产生白色沉淀,证明含有氯离子或是亚硫酸根离子中的一种,先加盐酸再加入氯化钡,产生白色沉淀,证明含有硫酸根离子,溶液中加入几滴硫酸,再加入金属铜,可以产生红棕色的气体,证明原溶液含有硝酸根离子,透过钴玻璃观察焰色反应呈现紫色,证明含钾离子,一定含有的钾离子是Na+、NH4+、K+ ,
所以答案是:Na+、NH4+、K+; ②溶液中加入几滴硫酸,再加入金属铜,可以产生红棕色的气体,证明原溶液含有硝酸根离子,金属铜可以和硝酸反应产生硝酸铜、一氧化氮和水,一氧化氮遇到空气迅速变为红棕色,即:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2 , 所以答案是:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2;③根据该实验不能确定样本中含有SO32﹣ , 加入硝酸酸化的硝酸银会产生白色沉淀,证明可能含有氯离子或是亚硫酸根离子中的一种,亚硫酸根离子可以和硝酸之间反应得到硫酸根离子,亚硫酸根离子可以使高锰酸钾褪色,但是硫酸根离子不能,可以采用高锰酸钾检验亚硫酸根离子的存在,所以答案是:否;酸性高锰酸钾溶液;(2)a.PM2.5是指大气中直径小于或等于2.5μm的颗粒物.它的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,故a正确;
b.PM2.5表面积大,具有吸附性,能吸附大量有毒物质,故b错误;
c.胶体微粒直径在10﹣7m~10﹣9m之间,PM2.5粒子的大小不符合,故c错误;
d.减少机动车尾气排放,减少了烟尘,能降低空气中PM2.5,故d正确;
故选:bc;(3)①尾气中SO2与氧气和石灰乳反应生成CaSO4和水,反应方程式为:2SO2+O2+2Ca(OH)2═2CaSO4+2H2O所以答案是:2SO2+O2+2Ca(OH)2═2CaSO4+2H2O;
②尾气中NO、NO2与石灰乳反应生成Ca(NO2)2和水,反应方程式为NO+NO2+Ca(OH)2═Ca(NO2)2+H2O;所以答案是:NO+NO2+Ca(OH)2═Ca(NO2)2+H2O.


科目:高中化学 来源: 题型:
【题目】实验室制取氯气的化学方程式:4HCl(浓)+MnO2 ![]() Cl2↑+MnCl2+2H2O,
Cl2↑+MnCl2+2H2O,
(1)反应物HCl中氯元素的化合价 .
(2)在该氧化还原反应中,MnO2 做剂,锰元素被 . 而HCl在反应中表现的性质包括和 .
(3)若有6molCl2生成时,反应中转移mol电子.
(4)写出该反应的离子方程式 , 用双线桥法标出电子转移的方向和数目: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1LK2SO4和CuSO4的混合溶液中,C(SO42﹣)=2molL﹣1 , 用石墨作电极电解该溶液,当通电一段时间后,两极均收集到22.4L(标况)气体,则原溶液中k+的物质的量浓度为( )
A.2molL﹣1
B.3 molL﹣1
C.1molL﹣1
D.0.5 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热. 
起始温度t1/℃ | 终止温度t2/℃ | 温度差 | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指温度;
(4)计算该实验发生中和反应时放出的热量为kJ[中和后生成的溶液的比热容c=4.18J(g℃)﹣1 , 稀溶液的密度都为1gcm﹣3];
(5)如果用50mL 0.55mol/L的氨水(NH3H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2 , 在催化剂的作用下发生反应:CO(g)+Cl2(g)COCl2(g)△H=a kJ/mol
反应过程中测定的部分数据如表:
t/min | n (CO)/mol | n (Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
(1)比较各时段平均速率v(COCl2):v(0﹣1)v(0﹣2);v(0﹣2)v(1﹣2) (填“>”、“=”或“<”).
(2)在2min~4min间,v(Cl2)正v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=
(3)已知X、L可分别代表温度或压强,如图表示L一定时,CO的砖化率随X的变化关系.
X代表的物理量是;a0 (填“>”,“=”,“<”),依据是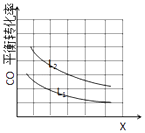
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中所含原子个数由多到少的顺序正确的是
①0.5mol的氯气②标准状况下22.4L氢气③4℃时9mL的水④0.2mol的磷酸
A. ①④③② B. ④③②① C. ②④③① D. ①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
A.a g C2H4和C3H6的混合物所含原子总数为 ![]()
B.常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA
C.标准状况下,22.4 L H2O含有的分子数为 NA
D.物质的量浓度为0.5 mol·L1的MgCl2溶液中,含有Cl个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用键能的大小来解释的是( )
A.N元素的电负性较大,但N2的化学性质很稳定
B.稀有气体一般难发生反应
C.HF,HCl,HBr,HI的稳定性逐渐减弱
D.F2比O2更容易与H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于CH4的叙述中不正确的是
A. CH4是无色、无味、极难溶于水的气体
B. CH4的键长相等,键角相同,正四面体结构
C. CH4能使酸性高锰酸钾溶液褪色
D. CH4和Cl2在光照条件下反应得到多种油状物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com